Inflamación intrauterina y Daño cerebral
Mayo 2016
Inflamación intrauterina, consumo cerebral de oxígeno y susceptibilidad a daño cerebral temprano en RNMPBN
Michael J Stark y Cols Arch Dis Child Fetal Neonatal Ed 2016
Traducción libre Dra Andrea Gómez Pediatra Servicio de Neonatología Hospital Puerto Montt Chile
¿ Qué es lo ya conocido en este tema ?
La exposición a inflamación in útero aumenta la incidencia y severidad de P / IVH temprana en RNPT.
Una fracción de extracción de oxígeno cerebral precede al desarrollo de P / IVH en RNPT.
La información de estudios en animales indica que el consumo de oxígeno cerebral está elevado posterior a la exposición a la inflamación intrauterina.
Introducción
Más del 40% de los RNPT < 32 semanas estarán expuestos a coriamnionitis1. La inflamación in útero se relaciona con nacimiento prematuro2 y aumenta la incidencia y severidad de hemorragia periventricular / ventricular (P/IVH)3. Los mecanismos por los cuales la inflamación intrauterina lleva a lesión cerebral permanecen poco claros, aunque las hipótesis incluyen efectos directos de las citoquinas inflamatorias en el cerebro4 y/o alteración circulatoria causada por la misma inflamación.5
La inflamación intrauterina tiene efectos significativos en la hemodinamia sistémica y cerebral llevando a un aumento de la vulnerabilidad de los RNPT a lesión cerebral6. Una entrega inadecuada de oxígeno causa vasodilatación compensatoria de la vasculatura cerebral7 aunque esta respuesta es disminuída por la exposición a la inflamación antenatal8. En el contexto de una entrega subóptima de oxígeno aumenta la extracción cerebral de oxígeno para mantener una adecuada oxigenación tisular9. Sin embargo, la falla de esta respuesta probablemente causa hipoxia-isquemia crítica con metabolismo anaeróbico y potencial lesión.
El consumo cerebral de oxígeno refleja la actividad metabólica10 y varía en RN quienes posteriormente desarrollaron P / IVH9. Datos en animales indican que el consumo cerebral de oxígeno es elevado posterior a la exposición a la inflamación intrauterina11. La extracción de oxígeno es esencialmente la proporción de oxígeno descargada desde la Hb durante el paso por los tejidos. Matemáticamente es la relación que mide la suficiencia entre la entrega y consumo de oxígeno12. Otros y nosotros hemos mostrado previamente que una elevada extracción de oxígeno cerebral precede al desarrollo de P/IVH temprana en RNMBPN13-14.
El propósito de este estudio fue determinar si la exposición a inflamación intrauterina se asoció con cambios en cinética del oxígeno cerebral durante la transición entre la vida intra y extra uterina. Hipotetizamos que la exposición a inflamación intrauterina causa un consumo de elevado de oxígeno cerebral, llevando potencialmente a una hipoxia-isquemia crítica y por lo tanto, aumentando el riesgo de malos resultados en RNPT.
Métodos
Participantes en el estudio
Se reclutaron RNPT < 30 semanas de EG nacidos en Hospital Materno Infantil de Adelaida (Australia) para estudios de cinética de oxígeno cerebral13. Se excluyeron aquellos con anormalidades congénitas con riesgo vital o cardiopatías congénitas. Características demográficas y clínicas fueron registradas de los archivos médicos. Las mediciones del estudio incluyeron ecografía de cráneo y espectroscopía cercana al infrarrojo cerebral (NIRS), las que se realizaron en los días 1 y 3 de vida con un outcome pobre temprano definido como P / IVH mayor grado II al día 3 de vida.
Un patólogo, independiente de los investigadores del estudio, realizó un examen histológico a la placenta usando un protocolo estándar para todos los RN como parte del examen clínico de rutina. Se definió corioamnionitis histológica por evidencia de neutrófilos en el trofoblasto sub-coriónico fibronoso/membranoso, corion y/o amnios, infiltración neutrofílica de los vasos fetales de la placa coriónica (vasculitis coriónica) y/o infiltración de los vasos del cordón umbilical (vasculitis umbilical o funisitis) 16.
Entrega y consumo de oxígeno cerebral
El índice de oxígeno tisular (TOI) se midió por NIRS (Hamamatsuv NIRO-200, Hamamatsu Photonics K. K Hamamatsu City, Japan) como se describió previamente13. El sensor se localizó en la región frontotemporal derecha y la información se capturó en intervalos de 1 s. Se registró un periodo continuo de 30 minutos posteriores a 15 minutos de la instalación del NIRS para permitir la estabilización de la señal. Un periodo de 10 minutos de datos estables fue promediado para la determinación de TOI y se usaron ecuaciones de cinética de oxígeno como sustituto de la saturación venosa cerebral de oxígeno. No se realizó NIRS dentro de 2 horas de una intervención clínica que alterara el aporte de oxígeno cerebral y su extracción, incluyendo la administración de surfactante17, indometacina / ibuprofeno 18 y cafeína19.
Un solo operador (KKBV) midió ambos flujos sanguíneos de la carótida interna por ultrasonido doppler como está descrito previamente13. Ambos flujos, derecho e izquierdo fueron medidos para calcular el flujo carotídeo total (Philips iE33 Ultrasound System, USA). El mismo operador realizó una ecocardiografía funcional incluyendo la medición de gasto cardiaco biventricular y la presencia de ductus arterioso (incluyendo la dirección del flujo). Al finalizar el estudio con NIRS, se midió la concentración de Hb arterial, lactato, pH, paO2 y paCO2 a través de un co-oxímetro (Radiometer Copenhagen, ABL 725, Denmark).
Cálculos
La fracción de extracción de oxígeno tisular cerebral (cFTOE) se calculó con la fórmula: cFTOE=[(SaO2 − TOI)/SaO2], donde SaO2 es la saturación sistémica arterial (co-oximetría), TOI fue usado en lugar de la saturación venosa cerebral de oxígeno13. Se calculó la entrega de oxígeno cerebral modificada (mCerbDO2) a partir de la fórmula: mCerbDO2 = (CBF× ((1.39×Hb×Hbsat/100) + (0.003×PaO2)), donde el flujo sanguíneo total de la carótida interna fue usado para sustituir al flujo sanguíneo cerebral (CBF); Hb es la concentración de hemoglobina (g/dL) y Hbsat es la saturación de hemoglobina. El consumo de oxígeno cerebral modificado (mCerbVO2) se calculó de acuerdo al principio de Fick, que es mCerbVO2= (CBF• (SaO2 − TOI)), donde TOI se usó como sustituto de saturación venosa de oxígeno cerebral.
Análisis estadístico
La información demográfica fue comparada usando análisis de varianza. Datos de frecuencia fueron analizados usando test exacto de Fisher. Las diferencias en la hemodinamia cerebral y medidas de oxigenación fueron evaluadas usando un análisis de covarianza 2 (mal resultado temprano vs no P/IVH)x2 (inflamación vs no inflamación) con la edad gestacional usada como covarianza. Análisis estadísticos fueron realizados con SPSS V.20.0 (SPSS, Chicago, Illinois, USA).
Resultados
Las características clínicas de los 83 RN en el estudio se muestran en la tabla 1. Los RN fueron dicotomizados de acuerdo a presencia o ausencia de coriamnionitis histológica (grupos con inflamación y sin inflamación) y Outcome principal (P/IVH o no P/IVH). Los niños en el grupo con inflamación + P/IVH eran de menor edad gestacional (p=0,01), mientras que aquellos diagnosticados con P/IVH tenían Clinical Risk Index ó Indice Clínico de Riesgo para RN (CRIB) II más alto (p=0.002) y el lactato de arteria umbilical fue más alto en los expuestos a inflamación intrauterina (p=0.03). 29 mujeres en el grupo con inflamación (73%) tenían diagnóstico clínico de corioamnionitis. 6 placentas en el grupo con inflamación exhibían evidencia histológica de respuesta inflamatoria materna (neutrófilos en trofoblasto subcoriónico fibrinoso/ membranoso, corion y/o amnios). Las 34 restantes mostraban infiltración neutrofílica de los vasos fetales de la placa coriónica (vasculitis coriónica) y/o infiltración de los vasos del cordón umbilical (vasculitis umbilical o funisitis) consistente con inflamación feto-placentaria16. 9 placentas (21%) en el grupo sin inflamación mostraron aumento del número de nudos sinciciales y 6 (14%) tenían evidencia de villitis no específica.

19 RN fueron diagnosticados con P/IVH a las 72 horas de edad. 7 tenían evidencia a la ecografía de P/IVH al momento del estudio con NIRS (todos con IVH unilateral grado 1 con extensión subsecuente a grado > 2 a las 72 horas de vida) con una mayor proporción en el grupo con inflamación (p=0.05). A las 72 horas de vida, la proporción de RN con P/IVH no fue diferente entre los grupos con y sin inflamación (p=0.33). El lactato de arteria umbilical fue más alto en el grupo con inflamación comparado con el sin inflamación (p=0.03). Dado que la edad gestacional fue mayor en el grupo sin inflamación y sin P/IVH comparado con todos los otros grupos (p=0.01), se ingresó a un análisis como una covariable potencial, pero no se correlacionó con mCerbDO2, mCerbVO2 o cFTOE.
El score CRIB II fue más alto en los RN diagnosticados con P/IVH a las 72 h de vida (p=0.002). Si bien la PaCO2 medida en primer punto de tiempo estudiado fue más alta en los RN que desarrollaron P/IVH (p=0.03) independiente de la exposición a la inflamación, no hubo diferencias entre los grupos para PaCO2 o SpO2. Además no se vieron diferencias para otras variables conocidas que impacten en la cinética del oxígeno cerebral incluyendo la ventilación mecánica recibida, apoyo inotrópico o tratamiento de DAP clínicamente significativo. La media de edad (DE) para los RN al momento de los estudios con NIRS y la primera ecografía fue de 14 (7) horas. No hubo diferencias entre los grupos.
Flujo sanguíneo cerebral y entrega de oxígeno: consumo en el 1er día de vida
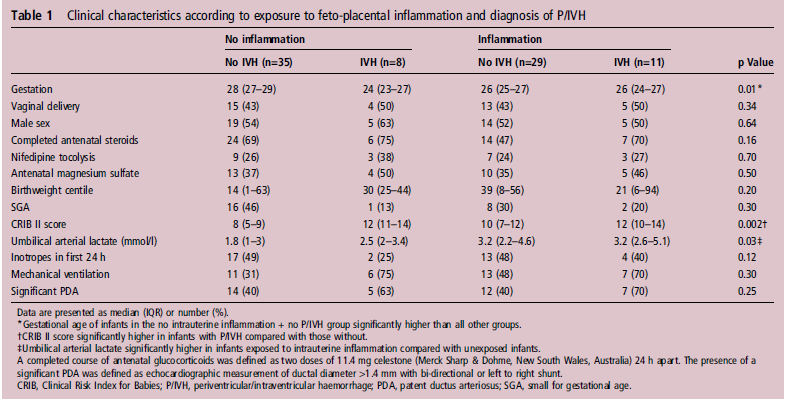
Sin diferencias en la presión arterial media y gasto cardiaco del ventrículo derecho (RVO) entre grupo con inflamación y sin inflamación o entre RN con y sin P/IVH. El flujo sanguíneo total de carótida interna (p=0.02) y por lo tanto, modCerbDO2 (p < 0.01) fue más alto en el grupo con inflamación comparados con aquellos no expuestos a inflamación intrauterina (figura 1A).
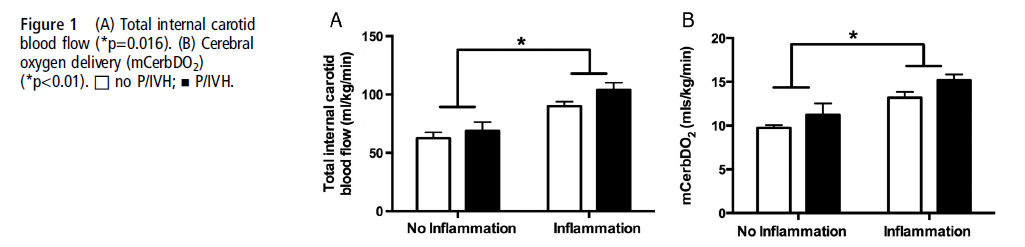
Se observó una significativa interacción para el mCerbVO2 (p=0.04; figura 2A). Análisis post hoc demostraron que en el grupo con inflamación mCerbVO2 fue más alto en RN con P/IVH (p=0.01), aunque este efecto no fue visto en RN en el grupo sin inflamación. En suma, en RN con P/IVH, mcerbVO2 fue más alto en aquellos expuestos a la inflamación que en los no expuestos (p=0.01).
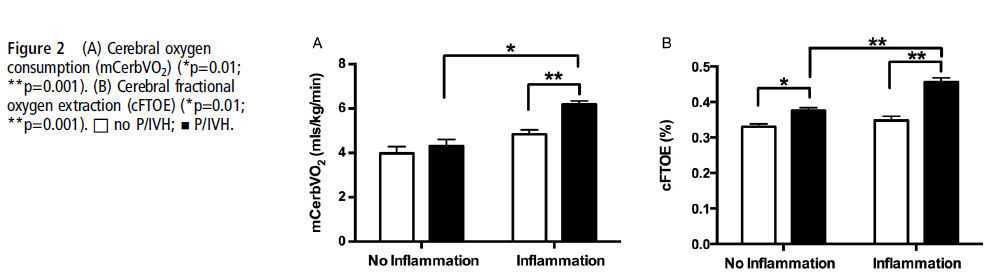
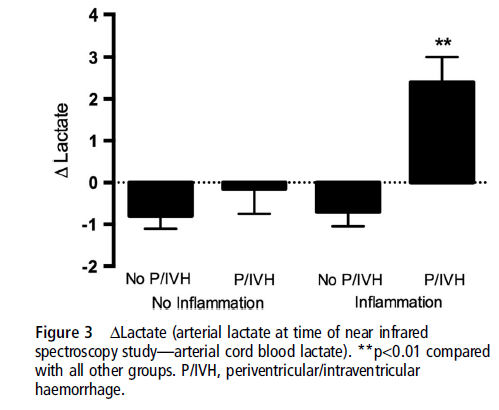
Como se esperaba, se evidenció un interacción significativa de inflamación y P/IVH también vista para cFTOE (p=0.03). Análisis post hoc demostraron que cFTOE fue más alto en todos los RN con P/IVH independiente de la exposición a inflamación intrauterina (grupos sin inflamación (p=0.01) y grupo sin inflamación (p=0.001)) (Figura 2B) y mayor para los RN con P/IVH expuestos a inflamación comparados con los con P/IVH no expuestos a inflamación intrauterina (p=0.001). Consistente con estos hallazgos, el ΔLactato (lactato arterial al momento del estudio menos lactato de arteria umbilical) fue distinto entre el grupo con inflamación y P/IVH comparado con todos los otros grupos (p < 0.01) (figura 3)
Flujo sanguíneo cerebral y entrega de oxígeno: consumo en el 3er día de vida.
La edad media (DE) de los RN al momento de los estudios con NIRS y ecografía en el 3er día fue 76 (8). No hubo diferencia en el flujo sanguíneo de carótida interna total, mCerbDO2 o mCerbVO2 entre los grupos. cFTOE fue mayor en los RN con P/IVH independiente de la exposición a inflamación intrauterina (p=0.03), aunque fue menor que la medida antes de las 24 horas de vida.
Discusión
La exposición a inflamación intrauterina independiente de la causa aumenta la incidencia y severidad de P/IVH en RNMBPN 3, los mecanismos por los cuales la inflamación fetal contribuyen a la lesión cerebral neonatal aún no están completamente caracterizados. En el estudio actual, se observó P/IVH más frecuentemente en niños expuestos a inflamación intrauterina y se asoció con aumento del consumo de oxígeno cerebral en el primer día de vida. Si bien se observó mayor CBF y entrega de oxígeno en RNPT expuestos a inflamación intrauterina, el aumento de la carga metabólica cerebral impuesta por la inflamación parece superar estos ajustes compensatorios, resultando en un cFTOE elevado. Por si misma la inflamación intrauterina puede aumentar la susceptibilidad a P/IVH temprana a través de los efectos adversos en la fisiología del oxígeno cerebral 13 , 14.
Mientras que los datos actuales son consistentes con hallazgos en un modelo ovino de inflamación intrauterina11,20, pocos estudios en humanos han investigado la asociación entre la inflamación fetal y la hemodinamia cerebral alterada 8, 21-23 y ninguno ha evaluado el efecto en la entrega de oxígeno cerebral y su consumo. El periodo de transición posterior al parto prematuro es particularmente vulnerable para el desarrollo de P/IVH con un 50% que sucede en las primeras horas de vida24. Hemos demostrado previamente que una cFTOE elevada en las primeras 24 horas de vida puede identificar a los RN en riesgo aumentado de resultado adverso temprano13. Si bien no se vió diferencia en la cantidad de RN con P/IVH en los grupos con y sin inflamación a las 72 h de vida, hubo más RN en el grupo con inflamación que tuvieron P/IVH a las 24 horas de vida. Consistente con esto, las diferencias en la entrega de oxígeno cerebral, consumo y cFTOE no fueron más tiempo aparentes a las 72 horas de vida.
La exposición a inflamación prenatal resulta en un aumento de frecuencia cardiaca y carga de volumen25 y disminución de la presiones arterial media y diastólica en el periodo postnatal inmediato22. No encontramos diferencias entre la presión arterial media ó RVO entre los grupos con y sin inflamación consistentes con la sugerencia que esos efectos sean gestación dependiente, no se observó hipotensión en la mayoría de los RNPT26. La exposición a inflamación intrauterina afectó las medidas de CBF, con un flujo sanguíneo total de carótida interna y entrega de oxígeno cerebral mayor en el grupo con inflamación. Esto es consistente con la información del aumento del flujo sanguíneo carotideo y de la entrega de oxígeno cerebral en fetos de oveja expuestos a inflamación intrauterina11 observado tanto in útero como inmediatamente posterior al parto 6 , 20. Aunque se ha especulado que tales aumento de CBF y entrega de oxigeno cerebral pueden ser mecanismos compensatorios requeridos para ajustarse al aumento de la demanda metabólica inducida por la inflamación, esto no ha sido previamente demostrado en RNPT.
Es probable que la inmadurez hemodinámica juegue un rol central en la patogénesis de P/IVH27. P/IVH es más común en RNMBPN con hipotensión28 y antecedente de bajo flujo de vena cava superior en el primer día de vida29. El manejo clínico de RN críticamente enfermos se ha enfocado en mantención de la presión arterial media con límites normales basado en la población30. Esto asume que manteniendo normotensión se optimiza la regulación de CBF, minimizando el riesgo de lesión cerebrovascular. Sin embargo, el aumento de CBF, especialmente si es fluctuante, también puede incrementar el riesgo de P/IVH31. Esto podría ser resultado de un robo ductal en RN con DAP. Aunque la prevalencia de DAP significativo parece ser más alta en RN con P/IVH, esto ni llega a ser estadísticamente significativo ni se observó evidencia de robo ductal en la medición de flujo sanguíneo de carótida interna total.
Nuestros datos muestran que la incidencia de P/IVH fue más alta en el grupo con inflamación comparado con el grupo sin inflamación, concordante con otros estudios 3,26,32,33. Si bien el flujo sanguíneo total de carótida interna y por lo tanto, la entrega de oxígeno estaban aumentados en el grupo con inflamación, no hubo diferencias en estos parámetros entre los grupos con y sin P/IVH. Sin embargo, se evidenciaron marcadas diferencias en el consumo de oxigeno cerebral y la extracción entre aquellos RN con P/IVH y aquellos sin P/IVH solo dentro del grupo con inflamación. Esto se reflejó por las diferencias en Δ lactato, el cual aumentó en el grupo con inflamación y P/IVH solos. Permanece poco claro por qué la inflamación impone esta aparente deuda de oxigeno adicional. Esto puede ser secundario al efecto directo en la vasculatura cerebral y/o un rápido aumento de las citoquinas proinflamatorias4, dado que la inflamación feto-placentaria ha sido previamente asociada con altos niveles de citoquinas proinflamatorias en sangre de cordón tales como IL-6 e IL-1α 22,34 y gran alteración hemodinámica22 y P/IVH temprano, pero no de comienzo tardío34. Las P/IVH de comienzo temprano más probablemente progresan a un grado más alto y están asociadas con riesgo aumentado de lesión de parénquima cerebral, mayor mortalidad neonatal e incidencia más alta de neuro-discapacidad subsecuente en los sobrevivientes35.
Se podría argumentar que los datos actuales describen una fase de reperfusión después de una lesión isquémica hipóxica, en lugar de cambios en la cinética de oxígeno cerebral siguientes aumentos inducidos por la inflamación en el consumo de oxígeno cerebral. Si bien, esto es difícil de determinar en RNPT, la evidencia en modelos de lesión hipóxico - isquémica en porcinos falla en demostrar un aumento de cFTOE durante la fase de reperfusión posterior a esta injuria36. Además, el aumento del flujo sanguíneo de la carótida y por lo tanto, la entrega de oxígeno que observamos con la exposición a la inflamación intrauterina es consistente con la evidencia de estudios en ovinos11,20,37. Entonces sugerimos que los cambios en la cinética del oxígeno que ocurren con la inflamación intrauterina improbablemente representan la reperfusión que sigue a la lesión hipóxico – isquémica. Nuestra investigación en marcha explora el potencial de la demanda de oxígeno no satisfecha de ser una clave que contribuye al proceso que lleva a una P/IVH temprana, como una consecuencia del daño celular hipóxico. Esta nueva evidencia indica que el balance entre el aporte y la demanda del oxígeno cerebral juega un rol crítico en estos procesos en los RNPT expuestos a inflamación intrauterina.
Hay limitaciones para la interpretación de la información actual que incluyen la medición del consumo de oxígeno por el método de Fick, el uso de TOI como reemplazo de la saturación venosa de oxígeno cerebral, datos derivados de un solo sensor de NIRS y CBF inferido de evaluación del flujo sanguíneo total carotideo interno por doppler. Sin embargo, cFTOE derivado de NIRS varía mínimamente entre regiones del cerebro38 y la información actual es consistente con la derivada de las mediciones en el dominio de la frecuencia del NIRS de múltiples zonas del cerebro39. Además, el muestreo episódico de medidas dinámicas tales como flujo sanguíneo carotideo interno total puede resultar en sobre interpretación, particularmente si varía entre RN la duración y severidad del manejo del oxígeno. Aunque el intervalo de mediciones fue corto, fue consistente con el tiempo requerido para las mediciones ecocardiográficas de función cardiaca y coincidió con un periodo sin estímulos externos e intervención farmacológica conocida que contaminara los datos obtenidos. Además, hay evidencia emergente que terapias antenatales, tales como, la administración materna de sulfato de magnesio, puede alterar la extracción cerebral de oxígeno40. Si bien la exposición a esta intervención neuroprotectora fue similar en los grupos, su efecto en la entrega cerebral de oxígeno y su consumo en RNMBPN requiere investigación adicional.
A la fecha, no hay intervenciones clínicas en el periodo neonatal inmediato que hayan alterado la incidencia de P/IVH. La entrega de oxígeno adecuada como prerrequisito para evitar la lesión de órganos diana, entendimiento de los componentes de la entrega de oxígeno y la naturaleza de la compensación para el aporte subóptimo en presencia de inflamación pueden permitir la identificación de RN que con más riesgo de lesión cerebral temprana. La identificación de extracción de oxígeno cerebral elevada (cFTOE) que precede al desarrollo de P/IVH temprana en RNMBPN13 14, puede hacer posible la identificación de aquellos RN con riesgo aumentado de lesión cerebral temprana. Este es un paso crítico en el desarrollo de intervenciones diseñadas con objeto de prevenir el riesgo aumentado de P/IVH asociado con la exposición a la inflamación intrauterina.
Referencias
Gantert M, Been JV, Gavilanes AW, et al. Chorioamnionitis: a multiorgan disease of the fetus? J Perinatol 2010;30(Suppl):S21–30.
Romero R, Espinoza J, Goncalves LF, et al. Inflammation in preterm and term labour and delivery. Semin Fetal Neonatal Med 2006;11:317–26.
Elimian A, Verma U, Beneck D, et al. Histologic chorioamnionitis, antenatal steroids, and perinatal outcomes. Obstet Gynecol 2000;96:333–6.
Viscardi RM, Muhumuza CK, Rodriguez A, et al. Inflammatory markers in intrauterine and fetal blood and cerebrospinal fluid compartments are associated with adverse pulmonary and neurologic outcomes in preterm infants. Pediatr Res 2004;55:1009–17.
Peebles DM, Miller S, Newman JP, et al. The effect of systemic administration of lipopolysaccharide on cerebral haemodynamics and oxygenation in the 0.65 gestation ovine fetus in utero. BJOG 2003;110:735–43.
Polglase GR, Nitsos I, Baburamani AA, et al. Inflammation in utero exacerbates ventilation-induced brain injury in preterm lambs. J Appl Physiol 2012;112:481–9.
Liem KD, Hopman JC, Oeseburg B, et al. The effect of blood transfusion and haemodilution on cerebral oxygenation and haemodynamics in newborn infants investigated by near infrared spectrophotometry. Eur J Pediatr 1997;156:305–10.
Yanowitz TD, Potter DM, Bowen A, et al. Variability in cerebral oxygen delivery is reduced in premature neonates exposed to chorioamnionitis. Pediatr Res 2006;59:299–304.
Kissack CM, Garr R, Wardle SP, et al. Postnatal changes in cerebral oxygen extraction in the preterm infant are associated with intraventricular hemorrhage and hemorrhagic parenchymal infarction but not periventricular leukomalacia. Pediatr Res 2004;56:111–16.
Altman DI, Perlman JM, Volpe JJ, et al. Cerebral oxygen metabolism in newborns. Pediatrics 1993;92:99–104.
Andersen CC, Pillow JJ, Gill AW, et al. The cerebral critical oxygen threshold of ventilated preterm lambs and the influence of antenatal inflammation. J Appl Physiol 2011;111:775–81.
Yoxall CW, Weindling AM. Measurement of cerebral oxygen consumption in the human neonate using near infrared spectroscopy: cerebral oxygen consumption increases with advancing gestational age. Pediatr Res 1998;44:283–90.
Balegar KK, Stark MJ, Briggs N, et al. Early cerebral oxygen extraction and the risk of death or sonographic brain injury in very preterm infants. J Pediatr 2014;164:475–80.e1.
Noori S, Stavroudis TA, Seri I. Systemic and cerebral hemodynamics during the transitional period after premature birth. Clin Perinatol 2009;36:723–36, eng.
Papile LA, Burstein J, Burstein R, et al. Incidence and evolution of subependymal and intraventricular hemorrhage: a study of infants with birth weights less than 1,500 gm. J Pediatr 1978;92:529–34.
Redline RW, Faye-Petersen O, Heller D, et al. Amniotic infection syndrome: nosology and reproducibility of placental reaction patterns. Pediatr Dev Pathol 2003;6:435–48.
Skov L, Ryding J, Pryds O, et al. Changes in cerebral oxygenation and cerebral blood volume during endotracheal suctioning in ventilated neonates. Acta Paediatr 1992;81:389–93.
Van Bel F, Van de Bor M, Stijnen T, et al. Cerebral blood flow velocity changes in preterm infants after a single dose of indomethacin: duration of its effect. Pediatrics 1989;84:802–7.
Hoecker C, Nelle M, Poeschl J, et al. Caffeine impairs cerebral and intestinal blood flow velocity in preterm infants. Pediatrics 2002;109:784–7.
Galinsky R, Hooper SB, Wallace MJ, et al. Intrauterine inflammation alters cardiopulmonary and cerebral haemodynamics at birth in preterm lambs. J Physiol 2013;591(Pt 8):2127–37.
Sorensen LC, Maroun LL, Borch K, et al. Neonatal cerebral oxygenation is not linked to foetal vasculitis and predicts intraventricular haemorrhage in preterm infants. Acta Paediatr Suppl 2008;97:1529–34.
Yanowitz TD, Jordan JA, Gilmour CH. Hemodynamic disturbances in premature infants born after chorioamnionitis: association with cord blood cytokine concentrations. Pediatr Res 2002;51:310–16.
Hahn GH, Maroun LL, Larsen N, et al. Cerebral autoregualtion in the first day after preterm birth: no evidence of association with systemic inflammation. Pediatr Research 2011;71:253–60.
Wells JT, Ment LR. Prevention of intraventricular hemorrhage in preterm infants. Early Hum Dev. 1995;42:209–33.
Furukawa S, Sameshima H, Ikenoue T. Circulatory disturbances during the first postnatal 24 hours in extremely premature infants 25 weeks or less of gestation with histological fetal inflammation. J Obstet Gynaecol Res 2008;34:27–33.
Salafia CM, Minior VK, Rosenkrantz TS, et al. Maternal, placental, and neonatal associations with early germinal matrix/intraventricular hemorrhage in infants born before 32 weeks’ gestation. Am J Perinatol 1995;12:429–36.
Soul JS, Hammer PE, Tsuji M, et al. Fluctuating pressure-passivity is common in the cerebral circulation of sick premature infants. Pediatr Res 2007;61:467–73.
Bada HS, Korones SB, Perry EH. Mean arterial blood pressure changes in premature infants and those at risk for intra-ventricular haemorrhage. J Pediatr 1990;117:607–14.
Osborn DA, Evans N, Kluckow M. Hemodynamic and antecedent risk factors of early and late peri/intraventricular hemorrhage in premature infants. Pediatrics 2003;112:33–9.
Cunningham S, Symon AG, Elton RA, et al. Intra-arterial blood pressure reference ranges, death and morbidity in very low birthweight infants during the first seven days of life. Early Hum Dev 1999;56:151–65.
Gronlund JU, Korvenranta H, Kero P, et al. Elevated arterial blood pressure is associated with peri-intraventricular haemorrhage. Eur J Pediatr 1994;153:836–41.
Morales WJ. The effect of chorioamnionitis on the developmental outcome of preterm infants at one year. Obstet Gynecol 1987;70:183–6.
Kaukola T, Herva R, Perhomaa M, et al. Population cohort associating chorioamnionitis, cord inflammatory cytokines and neurologic outcome in very preterm, extremely low birth weight infants. Pediatr Res 2006;59:478–83.
Babnik J, Stucin-Gantar I, Kornhauser-Cerar L, et al. Intrauterine inflammation and the onset of peri-intraventricular hemorrhage in premature infants. Biol Neonate 2006;90:113–21.
Vergani P, Patane L, Doria P, et al. Risk factors for neonatal intraventricular haemorrhage in spontaneous prematurity at 32 weeks gestation or less. Placenta 2000;21:402–7.
Tichauer KM, Wong DY, Hadway JA, et al. Assessing the severity of perinatal hypoxia-ischemia in piglets using near-infrared spectroscopy to measure the cerebral metabolic rate of oxygen. Pediatr Res 2009;65:301–6.
Galinsky R, Hooper SB, Polglase GR, et al. Intrauterine inflammation alters fetal cardiopulmonary and cerebral haemodynamics in sheep. J Physiol 2013;591(Pt 20):5061–70.
Wijbenga RG, Lemmers PM, van Bel F. Cerebral oxygenation during the first days of life in preterm and term neonates: differences between different brain regions. Pediatr Res 2011;70:389–94.
39 Grant PE, Roche-Labarbe N, Surova A, et al. Increased cerebral blood volume and oxygen consumption in neonatal brain injury. J Cereb Blood Flow Metab
2009;29:1704–13.
40 Verhagen EA, Kooi EM, van den Berg PP, et al. Maternal antihypertensive drugs may influence cerebral oxygen extraction in preterm infants during the first days after birth. J Matern Fetal Neonatal Med 2013;26:871–6.