Nueva escala de clasificación para Encefalopatía neonatal (EN)
Junio - 2021
Desarrollo, confiabilidad y prueba de una nueva Escala de calificación para Encefalopatía neonatal
Alfredo García-Alix, MD Journal of Pediatrics Abril 2021
La encefalopatía neonatal (EN) es una causa importante de muerte y discapacidades neurológicas permanentes en todo el mundo.1,2 El examen neurológico para identificar y categorizar rápidamente la gravedad de la EN dentro de las primeras 6 horas después del nacimiento es esencial para calificar a los bebés para la hipotermia terapéutica3-5. El primer examen neurológico y el más utilizado para EN es la evaluación de Sarnat y Sarnat, la cual clasifica a los bebés en 3 grados de gravedad durante la primera semana después del nacimiento.6 En la mayoría de los estudios se han utilizado versiones modificadas de este esquema para clasificar la gravedad de la EN. en las categorías leve, moderada o grave. 7-11 Sin embargo, estas escalas nominales no capturan la complejidad y amplitud de la disfunción neurológica, porque cada categoría incluye a bebés con un amplio rango de gravedad.
Se han estudiado otras escalas
de calificación. Por lo general, estas utilizan valores
numéricos asignados a cada elemento de una escala que se suman, y
los scores más altos indican peor severidad de la encefalopatía.8,9,12-18
Dos escalas de calificación para EN anteriores a la implementación
de la hipotermia terapéutica intentaron establecer la severidad de
la disfunción neurológica: el "score postasfixia",18
una escala compleja para usar dentro de las 24 horas posteriores al
nacimiento y la escala de Thompson, una escala ordinal con 9 ítems
puntuados de 0 a 3 para usarse durante los primeros tres días
después del nacimiento.9
Después de la introducción
de la hipotermia terapéutica, se desarrollaron otras 2 escalas de
clasificación para calificar la EN dentro de las primeras 6 horas:
el score de Sarnat total,19 y el score de la Sociedad
Iberoamericana de Neonatología.10 Mientras que el score
Sarnat total mostró una buena precisión para predecir la
discapacidad después de una EN leve, no se ha establecido la validez
predictiva del score de la Sociedad Iberoamericana de Neonatología.
Sin embargo, la consistencia interna, confiabilidad intraevaluación
y la relación entre los items que componen cada calificación o
escala nominal utilizada para calificar EN dentro de las primeras 6
horas después del nacimiento no han sido examinadas, lo que limita
su reproducibilidad y validez.
El objetivo de los autores objetivo fue 1) desarrollar y probar la confiabilidad de la Escala de Calificación (rating scala) de Encefalopatía Neonatal (NE-RS), una nueva escala de calificación específica para el grado de EN dentro de las primeras 6 horas después del nacimiento y 2) examinar la capacidad de la NE-RS como un predictor temprano de hallazgos en imágenes de resonancia magnética (MRI) y el resultado a los 2 años de edad.
Métodos
Este estudio fue parte de un proyecto de investigación global sobre EN .11,20-22 Los comités de estudios en humanos de las instituciones participantes aprobaron el estudio y se obtuvo el consentimiento informado de los padres. La NE-RS se desarrolló en 3 fases. Primero, diseñamos una escala completa para ser específica y sensible para identificar a los bebés nacidos a término con cualquier grado de severidad de EN, particularmente aquellos con mayor riesgo de un outcome anormal del neurodesarrollo y que fuese breve, sin redundancia y poco sofisticada. En la segunda fase, se evaluó la NERS en una cohorte de neonatos incluídos en un estudio prospectivo sobre EN, así como tambien en neonatos de control sanos nacidos a término. Finalmente, evaluamos el desempeño de la NE-RS correlacionando los resultados con los hallazgos en la resonancia magnética cerebral neonatal y el outcome a los 2 años de edad.
Fase 1: Desarrollo de una escala de
calificación específica y sensible para EN
Para seleccionar los ítems
más frecuentemente alterados en EN , se llevó a cabo un proceso
interactivo entre 3 neonatólogos con experiencia en neurología
neonatal. Los items elegidos se clasificaron ordinalmente para
cubrir el rango de disfunción neurológica. En aras de la brevedad,
se planeó evaluar toda la escala en < 10 minutos. Para facilitar la
simplicidad y promover la uniformidad durante la evaluación, se
incluyeron en el proyecto maniobras estandarizadas y una breve
explicación de las posibles respuestas.
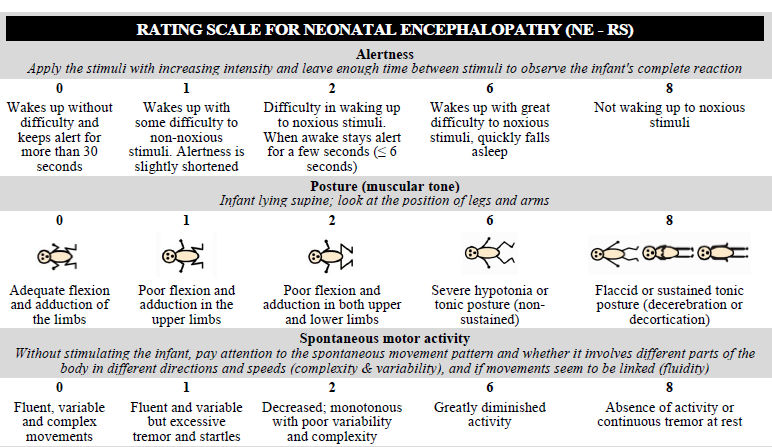
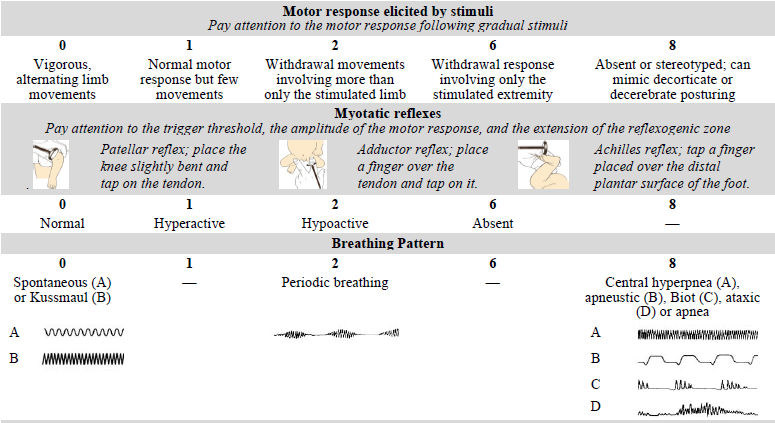
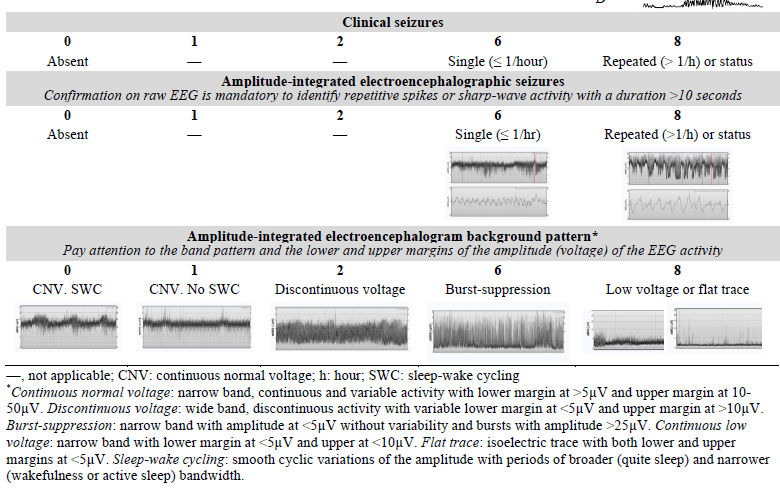
Siete variables clínicas se consideraron altamente relevantes para evaluar la EN: (1) estado de alerta, (2) actividad motora espontánea, (3) respuesta motora provocada por estímulos, (4) postura, (5) reflejos miotáticos, (6) patrones respiratorios y (7) convulsiones clínicas. Además, se agregaron 2 elementos de electroencefalografía de amplitud integrada (aEEG) (antecedentes y convulsiones eléctricas). Para evaluar un amplio rango de disfunción y discriminar los niveles de gravedad, cada ítem se puntuó ordinal y asimétricamente de 0 a 8 puntos, excepto el ítem de reflejos miotáticos, que se puntuó de 0 a 6. Se obtuvo un score total de la suma de los scores asignados a cada ítem, que va de 0 a 70 puntos (Tabla I; disponible en www.jpeds.com). Antes de la segunda fase del estudio, se instruyó a los médicos asistentes sobre cómo evaluar y puntuar los ítems.
Fase 2: Evaluación de la confiabilidad
entre evaluadores y la coherencia interna
La NE-RS se evaluó de forma
prospectiva en neonatos con EN. Los bebés nacieron consecutivamente
con ≥
34 semanas de gestación con peso
al nacer ≥
1800 g e ingresados en 2
hospitales universitarios de nivel III, entre abril de 2009 y julio
de 2011. También se incluyeron neonatos sanos nacidos a término,
aunque en esta cohorte no se monitorizó aEEG. La información
sobre los criterios de inclusión y exclusión se muestra en el
Apéndice (disponible en www.jpeds.com).
Dos investigadores con experiencia en neurología neonatal estuvieron
disponibles de llamada (on call) para evaluar a los bebés. La
estadificación clínica de la EN se estableció en cada centro con
base en nuestro esquema cualitativo de EN anterior, un esquema de
Sarnat modificado (Tabla II; disponible en
www.jpeds.com).11,22
La NE-RS fue evaluada de forma independiente por el investigador y
luego en 30 minutos por el neonatólogo tratante (11 médicos del
hospital participaron en las evaluaciones). En el momento de la
evaluación, el investigador desconocía la información perinatal y de
laboratorio, y su examen se consideró el estándar de oro.
Fase 3: Evaluación del rendimiento de la
escala a través de su correlación con los hallazgos de la resonancia
magnética y el outcome
Los
estudios de resonancia magnética se calificaron según un sistema de
calificación previamente validado, clasificando la lesión en 4
regiones del cerebro (corteza, ganglios basales - tálamo, sustancia
blanca y extremidad posterior de la cápsula interna) como leve (1
punto), moderada (2 puntos) , o grave (3 puntos).23 La
lesión moderada a grave se definió como score > 1 en cualquiera de
las estructuras evaluadas. Se consideró lesión de la sustancia gris
central en presencia de lesiones moderadas severas en los ganglios
basales-tálamo.
Patrón de cuenca hidrográfica
(watershed pattern) se definió como un score de 2-3 en la
sustancia blanca con ninguna o leve lesión de ganglio basal -
tálamo.
La evaluación del
neurodesarrollo de los neonatos sobrevivientes se llevó a cabo a los
24 meses de edad utilizando las Escalas de Bayley para Desarrollo
del lactante y niño pequeño, tercera edición (Bayley-III), la cual
contiene scores individuales (estandarizados para edad con una media
de 100; DE 15) para habilidades cognitiva, motora y lingüísticas.24
La parálisis cerebral (PC) se definió según la Vigilancia de PC en
Europa.25 Se utilizó el sistema de Clasificación de
Función Motora Gruesa (GMFCS) para graduar el compromiso
funcional en niños con parálisis cerebral.26
Un resultado adverso leve se
definió como GMFCS 1-2 o puntuación Bayley-III entre -1 DE y -2 DE
(puntuación 70-85). Un resultado adverso de moderado a grave se
definió como <2 DE (puntuación <70) en cualquier dominio de Bayley-III,
CP (GMFCS III-V) o muerte. Cualquier resultado adverso se definió
como una variable compuesta que abarcaba los resultados adversos
leves y de moderados a graves. Los niños no comprobables en
cualquier dominio de Bayley-III debido a una
disfunción motora o cognitiva grave se clasificaron como con un
resultado adverso grave.
Un outcome adverso leve se definió como GMFCS 1-2 o score Bayley-III entre -1 DE y -2 DE (score 70-85). Un outcome o resultado adverso de moderado a severo se definió como < 2 DE (score < 70) en cualquier dominio de Bayley-III, CP (GMFCS III-V) o muerte. Cualquier outcome adverso se definió como una variable compuesta que abarcaba los outcomes adversos leves y de moderados a graves. Los niños no testeables en cualquier dominio de Bayley-III debido a una disfunción motora o cognitiva grave se clasificaron como con outcome adverso grave.
Para los bebés cuyos padres no estaban de acuerdo con la prueba (n = 6), se realizó una evaluación por teléfono utilizando preguntas centradas en habilidades motoras y cognitivas; el outcome en estos 6 casos fue referido como normal por sus padres. Los outcomes no testeables y aquellos seguidos por llamada telefónica fueron categorizados , pero no se les asignaron scores numéricos de desarrollo a ellos.
Análisis estadístico
Las variables continuas se compararon utilizando el test de t de Student o prueba Mann-Whitney U en función de su distribución. Las variables categóricas se compararon mediante el test de C2 o la prueba exacta de Fisher. Todos los valores P reportados son de 2 caras y los valores P < .05 fuero considerados que indicaban significación estadística. El análisis estadístico se realizó utilizando el software Stata 15.0 (StataCorp).
Para examinar la consistencia interna de la escala como medida de confiabilidad (fase 2), estudiamos las correlaciones inter ítems para todos los pares de ítems y el coeficiente de confiabilidad NE-RS (alfa de Cronbach [a]). La concordancia entre observadores se evaluó mediante los coeficientes de correlación intraclase para cada ítem y el score NE-RS mediante el modelo aleatorio de 2 vías para la concordancia absoluta y se interpretó de acuerdo con la escala de fuerza de concordancia.27 Se calculó kappa ponderado cuadrático para estimar mejor el grado de desacuerdo entre el especialista y el neonatólogo tratante.
Para examinar la capacidad predictiva de la escala (fase 3) evaluamos la sensibilidad, la especificidad y los valores predictivos positivos y negativos, y realizamos análisis no paramétricos de la curva característica operativa del receptor para estimar el punto de corte óptimo para la máxima eficiencia.28 Los índices de precisión se obtuvieron después de determinar el mejor modelo utilizando el método de "todas las ecuaciones posibles" para la regresión logística.29 Permitimos submodelos no jerárquicos. Todas las combinaciones de items se calcularon y evaluaron a través de diferentes parámetros de bondad de ajuste : Cp de Mallow, criterios de información de Akaike, criterio bayesiano de Schwarz, Rsquared (R2), y R cuadrado ajustado (R2Adj).
Resultados
Enrolamos a 86 neonatos
(28 neonatos control y 58 pacientes consecutivos con EN); se
excluyeron 4 neonatos debido a accidentes cerebrovasculares
hemorrágicos (strokes) múltiples (n = 1), lesión de la médula
espinal (n = 1), ingreso tardío a los 5 días de edad (n = 1) y
falta de consentimiento informado de los padres (n = 1). De los 54
pacientes con EN , 12 tenían EN leve, 17 moderada y 25 grave según
el esquema de Sarnat modificado. Las principales características de
los grupos se muestran en Tabla III (disponible en
www.jpeds.com ). La consistencia
interna o confiabilidad de la escala, evaluada con el coeficiente
alfa de Cronbach, mostró un coeficiente de confiabilidad de 0.93 (IC
95%, 0.86- 0.94, Tabla IV y Tabla V; disponible en
www.jpeds.com) con una covarianza promedio inter items de 4.99. La
concordancia interobservador entre el investigador y el neonatólogo
tratante fue excelente, con un coeficiente de correlación intraclase
de 0.,99 (IC del 95% 0.99-0.,99; P <.001).
La mediana del score
NE-RS (IQR) fue 1 (0-2) en el grupo control y aumentó con cada
grado del esquema Sarnat modificado de la siguiente manera: 5
(4.0-5.5), 20 (12-24) y 45 (40-54) para EN leve, moderada y severa
(P <.001) (Figura 1; disponible en www.jpeds.com). Con base en los
scores de NE-RS para cada grado de gravedad de la EN,
estimamos los valores de corte óptimos : un score de 8 en la
NE-RS discrimina entre EN leve y moderada con un área bajo la curva
(AUC) de 0.99 (IC del 95%: 0.85-1.00). Un score de 30
diferencia entre EN moderada y grave con un AUC de 0.93 (IC del
95%: 0.81-0.99). Los índices de precisión para cada valor de corte
se pueden ver en detalle en Tabla VI.
Examinamos el score o puntuación global en comparación con cada ítem tomado por separado y se obtuvieron mejores índices de rendimiento para el score NE-RS total (Tabla VI y Tabla VII). Interesantemente, el estado de alerta, la postura, la respuesta motora y la actividad espontánea fueron las principales propiedades discriminatorias entre los grados de EN , mientras que los reflejos miotáticos, la respiración y la presencia de convulsiones clínicas fueron las menos discriminatorias (Tabla VII y Figura 2 [disponible en www.jpeds.com]). El estado de alerta fue el item independiente más importante para diferenciar entre EN leve y moderada (Tabla VII). Aunque el patrón de fondo aEEG tenía buenas propiedades discriminatorias, cuando se excluyó de la escala, el score clínico NE-RS tuvo una sensibilidad del 75%, una especificidad del 78%, un valor predictivo positivo del 71% y un AUC 0.99 % IC 0.98-1.00).
Habilidad predictiva
Los estudios de resonancia magnética se realizaron a una edad promedio de 238 horas (IQR 91-332). El score total de NE-RS se relacionó con el score de RM : Spearman Rho de 0.65 (P < .001) (Figura 3; disponible en www.jpeds.com). El score global NE-RS discriminó a neonatos con lesión moderada a grave en la resonancia magnética ( Tabla VI). El estado de alerta, postura, respuesta motora, actividad espontánea y patrón de fondo del aEEG tuvieron las mejores propiedades discriminatorias para predecir patrones alterados de resonancia magnética (Tabla VII).
El score NE-RS fue mayor en los 20 (43%) neonatos con patrón central de lesión de sustancia gris moderada a grave, con una mediana de 43 puntos (IQR 27-51), en comparación con los otros neonatos (mediana de 10 puntos [IQR 5-32]; P < .001). Entre los 27 neonatos sin patrón central de lesión en sustancia gris en la resonancia magnética, la mediana de scores NE-RS no difirieron entre aquellos con score de lesión de sustancia blanca de moderada a grave (2 o 3 puntos) versus aquellos con lesión de sustancia blanca leve o ninguna (score de 0 o 1) : 40 (5-45) vs 8.,5 (5-20.5); P = .18. Treinta y tres niños (61%) tuvieron un outcome adverso : 10 (19%) fueron clasificados como leves y 23 (43%) fueron clasificados como moderados a severos. Dieciocho bebés (33%) murieron a una mediana de edad 71 horas (IQR 38-93) (Tabla III). Excepto por 2 niños con EN moderada que murieron por insuficiencia respiratoria, los 16 niños restantes tenían EN grave y murieron después de retirar el soporte vital.
Los 21 neonatos con outcomes normales a los 24 meses tenían una mediana de valor de NE-RS de 6 (IQR 5-12), mientras que los 33 neonatos con outcomes adversos tenían una mediana de valor de 42 (IQR 44-48) (P < .001). La mediana de score NE-RS fue 44 (IQR 28-54) en neonatos con outcomes adversos de moderados a graves y 39 (IQR 20-44) en aquellos con outcomes adversos leves (P = .125). Figura 4 muestra la relación entre score NE-RS y outcome a los 2 años de edad según la clasificación EN.
La NE-RS mostró una buena capacidad para discriminar a los bebés que tuvieron resultados adversos. El estado de alerta, la postura, la respuesta motora, la actividad espontánea, la respuesta motora provocada por los estímulos y el patrón de fondo del aEEG fueron los elementos con propiedades discriminatorias máximas (Tabla VII). Encontramos que los puntos de corte de 17, 23 y 46 mostraron los mejores valores predictivos para el outcome adverso, el outcome adverso de moderado a grave y la muerte, respectivamente (Tabla VI).
También se realizó un análisis excluyendo a los 2 neonatos que fallecieron con EN moderada por insuficiencia respiratoria grave y no para decisiones de final de la vida en el contexto de EN grave. Los resultados fueron similares a los resultados de toda la cohorte para la discriminación de outcomes adversos (AUC 0.,92 [IC 95% 0.85-0.996]) y outcomes moderados a graves (AUC 0.87 [IC 95% 0.75-0.95]). Un punto de corte de 20 (AUC 0.82 [IC 95% 0.72- 0.93]), .23 (AUC 0.78 [IC del 95%: 0.67-0.89]) y 38 (AUC 0.78 [IC del 95%: 0.67-0.88]), mostraron los mejores valores predictivos para outcome adverso, outcome moderado a adverso y muerte, respectivamente.
Discusión
La NE - RS fue fácil de aplicar,
confiable y sensible en reflejar la gravedad de la EN al lado de la
cama dentro de las primeras 6 horas después del nacimiento, y tuvo
una fuerte asociación con la lesión cerebral en la resonancia
magnética, así como tambien una buena capacidad para predecir el
outcome neurológico a los 2 años. En contraste con las escalas
nominales, como la escala de Sarnat y otras escalas
de calificación,9,18,19 la NE-RS no utiliza categorizaciones
nominales de la gravedad de la EN, pero la estratifica en una escala
numérica. Esta estrategia, además de ayudar a identificar mejor a
los bebés que se beneficiarían más de la hipotermia terapéutica en
el desafiante escenario de tiempo de las primeras 6 horas después del
nacimiento, puede permitir estratificar a los pacientes en grupos de
riesgo según severidad y para comparar grupos más homogéneos de
recién nacidos en términos de gravedad en los estudios clínicos. Esto
representa una oportunidad para mejorar nuestra comprensión de EN y
su relación con el outcome. Además, podría ayudar a implementar
terapias neuroprotectoras más individualizadas y dirigidas por
grupos de gravedad.
Anteriormente, los
scores de gravedad estratificado, tales como el score total de Sarnat o la escala de Thompson dentro de las primeras 6 horas
después del nacimiento, han sido útiles para identificar a los
neonatos con EN leve en riesgo de outcome adverso 19
y para predecir un aEEG anormal dentro de las 6
horas posteriores al nacimiento o EHI de moderada a grave dentro de
las 72 horas de edad.17 Las puntuaciones de Sarnat o
Thompson también han sido predictivas de resultados a corto plazo
(muerte o desarrollo de convulsiones graves),30
outcomes a los 2
años de edad,16 o a una edad media de 53 meses.12
En la validación de las escalas, es importante testear la concordancia entre examinadores porque la fiabilidad depende de ello. Sólo un estudio ha examinado previamente la fiabilidad interobservador al aplicar un score Sarnat nominal modificado.31 Este estudio, realizado en recién nacidos levemente prematuros (32 - 36 semanas de edad gestacional), encontró una buena concordancia en la mayoría de los ítems excepto en el tono muscular y el reflejo de Moro, incluso entre examinadores de score Sarnat con experiencia o certificados. Nosotros encontramos una fiabilidad interobservador muy alta para la NE-RS, lo cual podría estar relacionado con la descripción clara de los ítems de la escala, los ítems que elegimos o la capacitación de los médicos en la aplicación de NE-RS.
No hay acuerdo sobre cuales ítems o categorías son suficientes y necesarios para establecer la gravedad de la EN o cuáles tienen mayor valor pronóstico. La NE-RS estaba constituída por 7 ítems clínicos y 2 ítems de aEEG adicionales. El análisis de confiabilidad no mostró redundancia entre los ítems. Se excluyó la evaluación de la función autonómica, al igual que Thompson et al.9 Algunos items de la función autónoma incluidos en la escala de Sarnat original, tales como las secreciones bronquiales y salivales y la motilidad gastrointestinal, son difíciles de estandarizar objetivamente. La evaluación pupilar se ha incluido sistemáticamente en las escalas de Sarnat modificadas.6,8,10,18,19,32
Sin embargo, su desempeño no está bien estandarizado, lo que genera inexactitudes significativas y una reproducibilidad deficiente.33 A pesar de algunos esfuerzos razonables para incluir definiciones clínicas estándar de midriasis o miosis,34 y una buena concordancia interobservador publicada previamente en 1 estudio en neonatos con EN, en nuestra experiencia,31 la evaluación objetiva de las pupilas es un desafío cuando no se utiliza un medidor de pupila o un pupilómetro, especialmente porque los recién nacidos tienen el iris oscuro, los párpados hinchados y, por lo general, cierran los ojos con fuerza en respuesta a la luz.35 Además, los opiáceos pueden usarse en neonatos con EN, ya sea durante el traslado al centro de referencia, en pacientes con ventilación mecánica, o para reducir la respuesta al estrés por frío durante la hipotermia.
También excluimos los reflejos primitivos incluidos en otros esquemas, ya que el reflejo de succión no es fácilmente evaluado en el neonato intubado y el reflejo de prensión habría sido redundante para otros items de la escala. Además, las maniobras para provocar el reflejo de Moro están vinculadas a un riesgo de lesión de médula si no se puede descartar con seguridad el daño espinal, son difíciles de estandarizar y se ha referido una concordancia deficiente entre los examinadores.31 Recientemente, Sarnat et al propusieron agregar los reflejos olfatorios a la graduación de EN. Sin embargo, esta interesante propuesta no ha sido testeada clínicamente.36
Ninguna de las escalas de calificación anteriores evaluó cuales elementos contribuyeron más a la gravedad de la EN. Nuestro estudio mostró que el estado de alerta era el elemento clave para discriminar entre EN leve y moderada, y que los patrones respiratorios, reflejos miotáticos y las convulsiones tenían poco valor para discriminar la gravedad de la EN dentro de las 6 horas posteriores al nacimiento. Entre todos los items , la combinación de estado de alerta, postura y patrones de movimiento (espontáneos y / o provocados por estímulos) mostró el mejor rendimiento diagnóstico. Además, nuestros hallazgos confirman que sólo se necesitan unos pocos elementos y una manipulación mínima para captar la gravedad de la EN.
Incluimos los items de aEEG en la NE-RS porque se ha informado que la actividad de fondo de aEEG durante las primeras 6 horas después del nacimiento es útil para identificar a los bebés con alto riesgo de un resultado anormal cuando se combina con un examen neurológico 37 y es un indicador de resultado a largo plazo sensible y específico en neonatos con EN.38-44 En nuestro estudio, los antecedentes de aEEG no aportaron un valor significativo al score clínico para discriminar entre grados de EN; sin embargo, fue el item más predictivo para anomalías en la RM y outcomes. Este hallazgo difiere de un estudio anterior que observó que la adición del fondo aEEG a las < 9 horas a la categorización clínica de NE moderada a grave a las 6 horas no mejoró el valor predictivo para muerte o discapacidad moderada / grave a los 18 meses.45 Esta diferencia puede deberse a que nuestro estudio también incluyó a neonatos con EN leve y no solo a pacientes con EN moderada o grave. Nuestro estudio mostró que la NE-RS se puede utilizar sin los 2 elementos aEEG, por ejemplo, en entornos con recursos limitados. Sin embargo, es importante señalar que la monitorización con aEEG ayuda a detectar y tratar las convulsiones electroencefalográficas y caracterizar aún más la evolución de la disfunción neurológica después de las 6 horas de vida.39,46
En nuestra opinión, un aspecto
original clave de la NE-RS es que la asignación numérica de cada ítem
no es simétrica, lo cual enfatiza la gravedad de la disfunción
neurológica. Esta estrategia de usar scores asimétricos para cada
uno de los ítems fue diseñada para superar la limitación de las
escalas simétricas ordinales donde una diferencia dada en el score
general en un punto no necesariamente representa la misma cantidad
de cambio funcional que una diferencia idéntica en otro punto de la
escala. Debido a esta asignación numérica asimétrica, la NE-RS
ofrece un rango de severidad dentro de las categorías clásicas de
Sarnat que es de particular importancia en niños con EN moderada que
varía de 8 a 30 puntos. Esto indica la gran limitación de las
escalas nominales tanto en términos de disminución de poder discriminativo como de heterogeneidad creciente al incluir diferentes
pacientes en la misma categoría, lo que dificulta la comparación de
los resultados entre estudios. Por tanto, la NE-RS debería permitir
una mejor estratificación de la enfermedad y la identificación de
aquellos niños que se beneficiarán más de la hipotermia terapéutica.
Nuestro estudio respalda el
valor del sistema Sarnat modificado utilizado como herramienta para
clasificar la gravedad de la encefalopatía neonatal (NE) dentro de
las primeras 6 horas de vida y predecir el pronóstico. Sin embargo,
la NE-RS ofrece la oportunidad de dar un paso más. En lugar de
aproximarse a la predicción exclusivamente en las tres
categorías fijas, la estratificación numérica brinda la oportunidad
de ajustar mejor la predicción de acuerdo con el valor numérico tan
pronto como dentro de las primeras 6 horas de vida.
Un punto fuerte de nuestro estudio es que las evaluaciones fueron realizadas por 2 examinadores (incluido el investigador ciego) en un cohorte prospectiva de neonatos a lo largo de todo el espectro de EN antes de iniciar la hipotermia terapéutica. Además, el proyecto NE-RS se estandarizó al igual que las medidas de outcome a los 24 meses. Nuestro estudio tiene algunas limitaciones potenciales. Primero, debido a la baja incidencia y prevalencia de EN, 1 por 1000 nacimientos en nuestro medio,47 el número de recién nacidos reclutados fue relativamente pequeño para la predicción de outcomes adversos y sería aconsejable la validación en estudios más grandes.
En segundo lugar, si bien se realizaron valoraciones antes de iniciar la hipotermia terapéutica y la sedación-analgesia en los centros de estudio, cabe señalar que el 67% de los pacientes incluidos fueron derivados desde otros hospitales y se les dió sedación antes o durante el traslado. Esto podría haber sido un factor de confusión al calificar con score a la NE-RS. Además, la alta tasa de pacientes remitidos en un momento inmediatamente posterior a la implementación de la hipotermia terapéutica en nuestro país (España) puede explicar en parte el elevado número de neonatos con EN grave y, por tanto, la alta mortalidad observada en nuestro estudio.
Excepto en 2 casos, las muertes fueron precedidas por una reorientación del cuidado después de un proceso de decisión al final de la vida basado en coma persistente y aEEG severamente anormal, así como tambien ecografías cerebrales o hallazgos de resonancia magnética compatibles con discapacidad severa en caso de supervivencia.
Cabe señalar que la NE-RS tenía como objetivo definir la severidad neurológica en las primeras horas después del nacimiento y examinar si la estratificación de esta gravedad en un score numérico puede proporcionar información de pronóstico. Si las evaluaciones seriadas de NE-RS más allá de las primeras 6 horas de vida pueden proporcionar una imagen precisa de la compleja naturaleza evolutiva de la EN durante los primeros días de vida y ofrecer mejores valores predictivos, está más allá del alcance de este estudio, pero merece atención en estudios adicionales.
Por este motivo, y a la espera de que otros
grupos reproduzcan resultados similares a los de este estudio en
poblaciones más amplias que también incluyan neonatos con criterios
de asfixia perinatal y sin EN, no eliminamos ninguno de los ítems de
la escala. Los items que requieren un mayor escrutinio son
aquellos que parecen no aumentar la precisión de la escala cuando se
aplica dentro de las primeras 6 horas después del nacimiento, o
discriminar la gravedad de la EN, o predecir un mal outcome o una
lesión en la resonancia magnética. Ellos incluyen reflejos miotáticos,
respiración, convulsiones clínicas y convulsiones
electroencefalográficas en el aEEG.
En resumen, la escala NE-RS
mostró una alta consistencia interna, confiabilidad entre
evaluadores y desempeño para evaluar la severidad de la lesión
neurológica dentro de las primeras 6 horas de vida posnatal.
La escala tenía buena precisión para predecir los outcomes a los 2
años de edad. La NE-RS podría ser una herramienta útil en la
práctica clínica para identificar a los bebés que califican para
hipotermia terapéutica, así como tambien para establecer una predicción
temprana de outcome en EN.
Referencias
-
Lee AC, Kozuki N, Blencowe H, Vos T, Bahalim A, Darmstadt GL, et al. Intrapartum-related neonatal encephalopathy incidence and impairment at regional and global levels for 2010 with trends from 1990. Pediatr Res 2013;74(suppl 1):50-72.
-
Kurinczuk JJ, White-Koning M, Badawi N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy. Early Hum Dev 2010;86:329-38.
-
Tagin MA, Woolcott CG, Vincer MJ, Whyte RK, Stinson DA. Hypothermia for neonatal hypoxic ischemic encephalopathy: an updated systematic review and meta-analysis. Arch Pediatr Adolesc Med 2012;166: 558-66.
-
Jacobs SE, Berg M, Hunt R, Tarnow-Mordi WO, Inder TE, Davis PG. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database Syst Rev 2013;1:CD003311.
-
Olsen SL, Dejonge M, Kline A, Liptsen E, Song D, Anderson B, et al. Optimizing therapeutic hypothermia for neonatal encephalopathy. Pediatrics 2013;131:e591-603.
-
Sarnat HB, Sarnat MS. Neonatal encephalopathy following fetal distress. A clinical and electroencephalographic study. Arch Neurol 1976;33: 696-705.
-
Fenichel GM. Hypoxic-ischemic encephalopathy in the newborn. Arch Neurol 1983;40:261-6.
-
Shankaran S, Laptook AR, Ehrenkranz RA, Tyson JE, McDonald SA, Donovan EF, et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med 2005;353:1574-84.
-
Thompson CM, Puterman AS, Linley LL, Hann FM, van der Elst CW, Molteno CD, et al. The value of a scoring system for hypoxic ischaemic encephalopathy in predicting neurodevelopmental outcome. Acta Paediatr 1997;86:757-61.
-
Perez JM, Golombek SG, Sola A. Clinical hypoxic-ischemic encephalopathy score of the Iberoamerican Society of Neonatology (Siben): a new proposal for diagnosis and management. Rev Assoc Med Bras (1992) 2017;63:64-9.
-
Alsina M, Martin-Ancel A, Alarcon-Allen A, Arca G, Gaya F, Garcia- Alix A. The severity of hypoxic-ischemic encephalopathy correlates with multiple organ dysfunction in the hypothermia era. Pediatr Crit Care Med 2017;18:234-40.
-
Mendler MR, Mendler I, Hassan MA, Mayer B, Bode H, Hummler HD. Predictive value of thompson-score for long-term neurological and cognitive outcome in term newborns with perinatal asphyxia and hypoxic-ischemic encephalopathy undergoing controlled hypothermia treatment. Neonatology 2018;114:341-7.
-
Shankaran S, Laptook AR, Tyson JE, Ehrenkranz RA, Bann CM, Das A, et al. Evolution of encephalopathy during whole body hypothermia for neonatal hypoxic-ischemic encephalopathy. J Pediatr 2012;160: 567-72.e3.
-
Shankaran S, Pappas A, Laptook AR, McDonald SA, Ehrenkranz RA, Tyson JE, et al. Outcomes of safety and effectiveness in a multicenter randomized, controlled trial of whole-body hypothermia for neonatal hypoxic-ischemic encephalopathy. Pediatrics 2008;122:e791-8.
-
Biselele T, Naulaers G, Tady B. Evolution of the Thompson score during the first 6 h in infants with perinatal asphyxia. Acta Paediatr 2014;103: 145-8.
-
Weeke LC, Vilan A, Toet MC, van Haastert IC, de Vries LS, Groenendaal F. A comparison of the thompson encephalopathy score and amplitude-integrated electroencephalography in infants with perinatal asphyxia and therapeutic hypothermia. Neonatology 2017;112: 24-9.
-
Horn AR, Swingler GH, Myer L, Linley LL, Raban MS, Joolay Y, et al. Early clinical signs in neonates with hypoxic ischemic encephalopathy predict an abnormal amplitude-integrated electroencephalogram at age 6 hours. BMC Pediatr 2013;13:52.
-
Lipper EG, Voorhies TM, Ross G, Vannucci RC, Auld PA. Early predictors of one-year outcome for infants asphyxiated at birth. Dev Med Child Neurol 1986;28:303-9.
-
Chalak LF, Adams-Huet B, Sant’Anna G. A total Sarnat score in mild hypoxic-ischemic encephalopathy can detect infants at higher risk of disability. J Pediatr 2019;214:217-221 e1.
-
Agut T, Leon M, Rebollo M, Muchart J, Arca G, Garcia-Alix A. Early identification of brain injury in infants with hypoxic ischemic encephalopathy at high risk for severe impairments: accuracy of MRI performed in the first days of life. BMC Pediatr 2014;14:177.
-
Leon-Lozano MZ, Arnaez J, Valls A, Arca G, Agut T, Alarcon A, et al. Cerebrospinal fluid levels of neuron-specific enolase predict the severity of brain damage in newborns with neonatal hypoxicischemic encephalopathy treated with hypothermia. PLoS One 2020;15:e0234082.
-
Carreras N, Alsina M, Alarcon A, Arca-Diaz G, Agut T, Garcia-Alix A. Efficacy of passive hypothermia and adverse events during transport of asphyxiated newborns according to the severity of hypoxic-ischemic encephalopathy. J Pediatr (Rio J) 2018;94:251-257.
-
Okereafor A, Allsop J, Counsell SJ, Fitzpatrick J, Azzopardi D, Rutherford MA, et al. Patterns of brain injury in neonates exposed to perinatal sentinel events. Pediatrics 2008;121:906-14.
-
Rescorla LA. Assessment of young children using the Achenbach System of Empirically Based Assessment (ASEBA). Ment Retard Dev Disabil Res Rev 2005;11:226-37.
-
Surveillance of Cerebral Palsy in E. Surveillance of cerebral palsy in Europe: a collaboration of cerebral palsy surveys and registers. Surveillance of Cerebral Palsy in Europe (SCPE). Dev Med Child Neurol 2000;42: 816-24.
-
Palisano R, Rosenbaum P, Walter S, Russell D, Wood E, Galuppi B. Development and reliability of a system to classify gross motor function in children with cerebral palsy. Dev Med Child Neurol 1997;39:214-23.
-
Brennan P, Silman A. Statistical methods for assessing observer variability in clinical measures. BMJ 1992;304:1491-4.
-
Zweig MH, Campbell G. Receiver-operating characteristic (ROC) plots: a fundamental evaluation tool in clinical medicine. Clin Chem 1993;39: 561-77.
-
Dom enech Massons JM, Navarro Pastor JB. Find the best subset for Linear, Logistic and Cox Regression: User-written command allsets for Stata. V1.2.0. 2016. In: Graunt21. 2016. Barcelona. p. Available executing from Stata: net. Accessed 13 June 2020. http://www.graunt.cat/stata
-
Thorsen P, Jansen-van der Weide MC, Groenendaal F, Onland W, van Straaten HL, Zonnenberg I, et al. The Thompson Encephalopathy Score and short-term outcomes in asphyxiated newborns treated with therapeutic hypothermia. Pediatr Neurol 2016;60:49-53.
-
Pavageau L, Sanchez PJ, Steven Brown L, Chalak LF. Inter-rater reliability of the modified Sarnat examination in preterm infants at 32-36 weeks’ gestation. Pediatr Res 2020;87:697-702.
-
Prempunpong C, Chalak LF, Garfinkle J, Shah B, Kalra V, Rollins N, et al. Prospective research on infants with mild encephalopathy: the PRIME study. J Perinatol 2018;38:80-5.
-
Couret D, Boumaza D, Grisotto C, Triglia T, Pellegrini L, Ocquidant P, et al. Reliability of standard pupillometry practice in neurocritical care: an observational, double-blinded study. Crit Care 2016;20:99.
-
Lally PJ, Montaldo P, Oliveira V, Soe A, Swamy R, Bassett P, et al. Magnetic resonance spectroscopy assessment of brain injury after moderate hypothermia in neonatal encephalopathy: a prospective multicentre cohort study. Lancet Neurol 2019;18:35-45.
-
Garcia-Alix A, Quero Jim enez J. Evaluaci on neurologica del reci en nacido. SA: Ediciones D ıaz de Santos; 2011.
-
Sarnat HB, Flores-Sarnat L, Fajardo C, Leijser LM, Wusthoff C, Mohammad K. Sarnat grading scale for neonatal encephalopathy after 45 years: an update proposal. Pediatr Neurol 2020;113:75-9.
-
Shalak LF, Laptook AR, Velaphi SC, Perlman JM. Amplitude-integrated electroencephalography coupled with an early neurologic examination enhances prediction of term infants at risk for persistent encephalopathy. Pediatrics 2003;111:351-7.
-
Toet MC, Hellstrom-Westas L, Groenendaal F, Eken P, de Vries LS. Amplitude integrated EEG 3 and 6 hours after birth in full term neonates with hypoxic-ischaemic encephalopathy. Arch Dis Child Fetal Neonatal 1999;81:F19-23.
-
Del Rio R, Ochoa C, Alarcon A, Arnaez J, Blanco D, Garcia-Alix A. Amplitude integrated electroencephalogram as a prognostic tool in neonates with hypoxic-ischemic encephalopathy: a systematic review. PLoS One 2016;11:e0165744.
-
Sewell EK, Vezina G, Chang T, Tsuchida T, Harris K, Ridore M, et al. Evolution of amplitude-integrated electroencephalogram as a predictor of outcome in term encephalopathic neonates receiving therapeutic hypothermia. Am J Perinatol 2018;35:277-85.
-
Shany E, Goldstein E, Khvatskin S, Friger MD, Heiman N, Goldstein M, et al. Predictive value of amplitude-integrated electroencephalography pattern and voltage in asphyxiated term infants. Pediatr Neurol 2006;35:335-42.
-
Azzopardi D , TOBY Study Group. Predictive value of the amplitude integrated EEG in infants with hypoxic ischaemic encephalopathy: data from a randomised trial of therapeutic hypothermia. Arch Dis Child Fetal Neonatal 2014;99:F80-2.
-
Murray DM, Boylan GB, Ryan CA, Connolly S. Early EEG findings in hypoxic-ischemic encephalopathy predict outcomes at 2 years. Pediatrics 2009;124:e459-67.
-
van Laerhoven H, de Haan TR, Offringa M, Post B, van der Lee JH. Prognostic tests in term neonates with hypoxic-ischemic encephalopathy: a systematic review. Pediatrics 2013;131:88-98.
-
Shankaran S, PappasA,McDonald SA, LaptookAR, Bara R, EhrenkranzRA, et al. Predictive value of an early amplitude integrated electroencephalogram and neurologic examination. Pediatrics 2011;128:e112-20.
-
Boylan GB, Kharoshankaya L, Mathieson SR. Diagnosis of seizures and encephalopathy using conventional EEG and amplitude integrated EEG. Handb Clin Neurol 2019;162:363-400.
-
Arnaez J, Garcia-Alix A, Arca G, Caserio S, Valverde E, Moral MT, et al. Population-based study of the national implementation of therapeutic hypothermia in infants with hypoxic-ischemic encephalopathy. Ther Hypothermia Temp Manag 2018;8:24-9.