Seguridad y eficacia CNAF en prematuros
Septiembre 2015
Seguridad y eficacia de tratamiento con Cánua nasal de alto flujo en prematuros : un meta-análisis
Sarah J. Kotecha Neonatology, University Hospital of Wales, Cardiff, United Kingdom Pediatrics Volume 136, number 3, September 2015
Traducción libre Dr Gerardo Flores Henríquez Pediatra Neonatólogo Puerto Montt Chile
La insuficiencia respiratoria que requiere apoyo invasivo con ventilación mecánica (VM) ó soporte no invasivo con modos nasales de ventilación, sigue siendo la morbilidad más común de los neonatos prematuros después del nacimiento.1 Estudios recientes sugieren tasas de sobrevida aumentadas de los prematuros extremos 1,2 con mayor número que requieren apoyo respiratorio.
Tradicionalmente, este apoyo ha sido en forma de ventilación mecánica invasiva (a través de un tubo endo-traqueal). Más recientemente estudios clínicos controlados randomizados han establecido los beneficios del soporte con ventilación no invasiva primaria de apoyo (VNI), especialmente para presión positiva continua de vía aérea nasal (nCPAP) 3,4 en comparación con VMI.5 Después de extubación de VM , la nCPAP ya se ha establecido como un modo eficaz de soporte .6 Otros modos de VNI en prematuros incluyen nCPAP de dos niveles (BiPAP) / ventilación nasal no invasiva con presión positiva (VNPPI) y cánula nasal de alto flujo humidificado y calentado (CNAF ó HHHFNC) . El uso de BiPAP / VNPPI como modo primario de asistencia respiratoria parece ser igualmente eficaz, 7 y clínicamente superior después de extubación desde VMI, 8 en comparación con nCPAP.
El modo más reciente de soporte respiratorio introducido para recién nacidos, CNAF , sin embargo, ha ganado rápidamente popularidad entre los médicos de todo el mundo, 9-13 aunque la evidencia que apoya su uso no estácompletamente establecida 14-16. Varios estudios clínicos durante la última década han recogido evidencia del uso de CNAf en recién nacidos prematuros, tanto como modo primario de apoyo al nacer como después de la extubación desde VM.
Los autores de este reporte realizaron una revisión sistemática y meta-análisis para recopilar toda la información publicada, para poder guiar la práctica clínica.
Métodos
Objetivos
El objetivo fue evaluar la eficacia y seguridad de CNAF como soporte respiratorio en neonatos prematuros (< 37 semanas de edad gestacional al nacimiento), en comparación con otros modos de VNI (ventilación no invasiva) incluyendo nCPAP y VNPPI ó BiPAP.
Criterio de inclusión
Se incluyeron estudios controlados, randomizados, prospectivos ó cuasi randomizados, controlados que incluían prematuros nacidos < 37 semanas. Estudios con grupos mixtos de niños (prematuros y a término) se incluyeron si estaba disponibles datos separados para prematuros (reportados en el texto, extraídos de los datos u obtenidos de los autores). No se excluyeron estudios basados en diagnóstico de la condición de la enfermedad en los niños. Subgrupos análisis se planificaron de forma prospectiva para < 32 s EG (≤ 1.500 g de peso al nacer ) y < 28 semanas EG ( ≤ 1.000 g PN), si los datos estratificados estaban disponibles. Para los estudios que utilizan PN como criterio de inclusión, se utilizó 1.000 g como sustituto para 28 semanas, 1.500 g para 32 semanas y 2.000 g para 36 semanas.
Se incluyeron estudios si los neonatos participantes intentaban ser m anejados con apoyo respiratorio no invasivo y asignados randomizadamente a CNAF ó cualquier otra forma de asistencia respiratoria no invasiva dentro de 24 horas del nacimiento, después de extubación de VM ó durante weaning de asistencia respiratoria no invasiva. Por lo menos uno o más de los outcomes (resultados) de revisión pertinentes (véase más adelante) debían haber sido ireportados en los resultados para considerar la inclusión.
Estrategia de búsqueda
Se desarrolló una estrategia de búsqueda usando palabras claves y términos Medical Subject Headings (MeSH), como se detalla en la Información Complementaria, a partir de 6 bases de datos: Embase, Health Management Information Consortium (HMIC), Medline, Scopus, Open SIGLE y Registro Cochrane Central de Controlled Trials (CENTRAL). Se buscó en las bases de datos en mayo 2014. Se buscaron referencias en los estudios incluidos para su inclusión. La búsqueda incluyó artículos en todos los idiomas de todos los países.
Outcomes
Los outcomes ó resultados primarios fueron el fracaso de terapia para establecer la eficacia y muerte, pérdidas de aire pulmonar y traumatismo nasal para establecer la seguridad. Se consideró cualquier definición de fracaso de terapia, debido a que había diferencias en cómo varios investigadores la definieron en los estudios. Se recogieron datos sobre varios resultados secundarios, incluyendo outcomes respiratorios (complicaciones respiratorias, modo y duración de la asistencia respiratoria, displasia broncopulmonar [BPD]), hemorragia intraventricular (HIV), y otros outcomes neonatales relevantes (sepsis, enterocolitis necrotizante [NEC], ductus arterioso [PDA], retinopatía del prematuro [RP], etc).
Definiciones
DBP se definió como requerimiento de soporte respiratorio y / o requerimiento de oxígeno suplementario a las 36 semanas de EG corregida. Si se realizó un test de oxígeno en aire ambiental a las 36 semanas EG corregida antes de categorización como DBP, entonces, sólo los neonatos que fallaban el test se consideraba tenían DBP.17 Los grados de de HIV fueron según la clasificación de Papile y cols 18 Clasificación de NEC fue según por Bell y cols 19 y modificado por Walsh y cols 20
Para los efectos de esta revisión, CNAF se definió como flujos humidificados calentados mayores a 2 L / min (flujo bajo se define como < 2 L / min). Sin embargo, la mayoría de los artículos recientes han utilizado velocidades de flujo de 5 al 8 L / min.
Recolección de datos
Se recogieron datos en las secciones de "características de los estudios y outcomes planificados", mediante un formulario de recolección de datos estandarizado (Tabla Suplementaria 5) por al menos dos autores de forma independiente, y luego se chequeó por entrecruzamiento para verificar su exactitud. Se hicieron intentos para aclarar los métodos y requerir datos estratificados de la gestación a los autores correspondientes en los artículos, en los que se incluían prematuros y recién nacidos a término. Estos se mencionan en las tablas correspondientes en la sección Resultados.
Análisis estadístico
Mediciones del efecto de tratamiento
El análisis estadístico se realizó mediante el uso de Review Manager (RevMan) versión 5.3 (Centro Cochrane Nórdico, The Cochrane Collaboration, 2014, Copenhague, Dinamarca).
Para los datos continuos, se recolectó la media y la SD (tal como duración de asistencia respiratoria) y se analizaron mediante diferencias de medias ponderadas (DMP). Para los datos categóricos (como muerte ó fracaso de tratamiento), los datos fueron extraídos para cada grupo de intervención y se calcularon odds ratio (OR) junto con intervalos de confianza del 95% (IC). La significación se fijó en P < 0,05. Un estudio reveló 21 outcomes (resultados) como medianas y rangos intercuartiles.
Medias y SD se calcularon a partir de estos datos mediante el uso de métodos publicadospreviamente.22,23 Para un estudio, 24 algunos datos se leen de figuras publicadas. Cada vez que se utilizaron estos datos para las estimaciones combinadas de los resultados en el meta-análisis, se llevó a cabo una evaluación de la sensibilidad para detectar diferencias en las estimaciones.
Evaluación del sesgo en estudios incluídos
En todos los estudios incluídos en el análisis final se evaluó el riesgo de sesgo mediante el uso de un flujo de ficha técnica basado en el dominio (como el usado por la Colaboración Cochrane). Dominios específicos examinados incluyen el sesgo de selección, sesgo de realización, sesgo de detección, sesgo de deserción (bajo riesgo: adecuado si < 10% de datos faltantes; alto riesgo: datos inadecuados si > 10% faltan), sesgo de notificación y cualquier otra forma de sesgo específico para el diseño del estudio. Para cada dominio, el riesgo de sesgo se clasificó como de bajo riesgo, alto riesgo o riesgo desconocido / incierto (si en los métodos se reportaban inadecuadamente los detalles). Para cada dominio, se realizó un juicio sobre la probable magnitud y dirección del sesgo y su probable impacto en los resultados ó outcomes. Los desacuerdos se resolvieron por consenso. Se hizo un análisis sobre el riesgo general de sesgo en base a los dominios anteriores.
Evaluación de heterogeneidad
La heterogeneidad se cuantificó usando Inaccuracy2 (I2) Estadística (http://handbook.cochrane.org/) y se estratificó como insignificante (I2 ≤ 49%) ó significativa (> 50%). En presencia de > 50% heterogeneidad, se realizó un análisis de sensibilidad para explicar la fuente de heterogeneidad. Para el cálculo de estimación combinada del tamaño del efecto, se utilizó un modelo de efectos fijos si se detectaba heterogeneidad insignificante y se utilizó un modelo de efecto randomizado si se detectaba heterogeneidad significativa.
Resultados
Selección de estudios
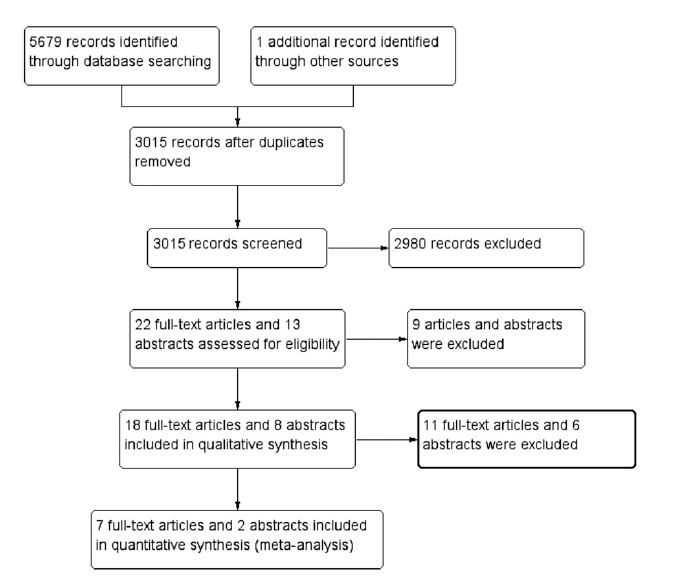
Los resultados de la búsqueda y filtrado en las diferentes etapas se representa en la figura 1. Los detalles completos de los términos de búsqueda, con la secuencia de búsqueda se presentan en la sección Información adicional.

Figura 1 .- Diagrama de flujo que describe etapas de resultados de la búsqueda y filtrado según las guías de Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) .
Descripción de estudios
Dieciocho estudios publicados como artículos full text 21,24-40 texto completo y 8 estudios publicados como resúmenes ó abstracts 41-48 fueron considerados inicialmente para la revisión.
De los estudios publicados como artículos de texto completo, 2 utilizaron terapia de alto flujo no calentado, 25,36 ; 7 fueron estudios randomizados con secuencia de cruce, 28,30,31,35-37,39 ; 2 compararon diferentes modalidades de terapia de alto flujo, 32 39 y 1 expresó datos de traumatismo nasal como scores.26
De los estudios publicados como resúmenes (abstract) , 2 eran estudios cruzados con secuencia al azar, 41,47 ; 2 no tenían datos en bruto adecuados para la puesta en común, 42,48 ; 1 comparó CNAF con VM 46 y 1 estudio incluyó neonatos a término y prematuros , sin datos separados para prematuros.43
Estos 17 estudios fueron excluídos porque no se pudo extraer datos relevantes para nuestro análisis (Tabla Suplementaria 8). Por lo tanto, se incluyeron 7 estudios publicados como artículos de texto completo y 2 estudios publicados como resúmenes en la revisión final (Tabla 1).
Tabla 1.- Características de los estudios incluídos
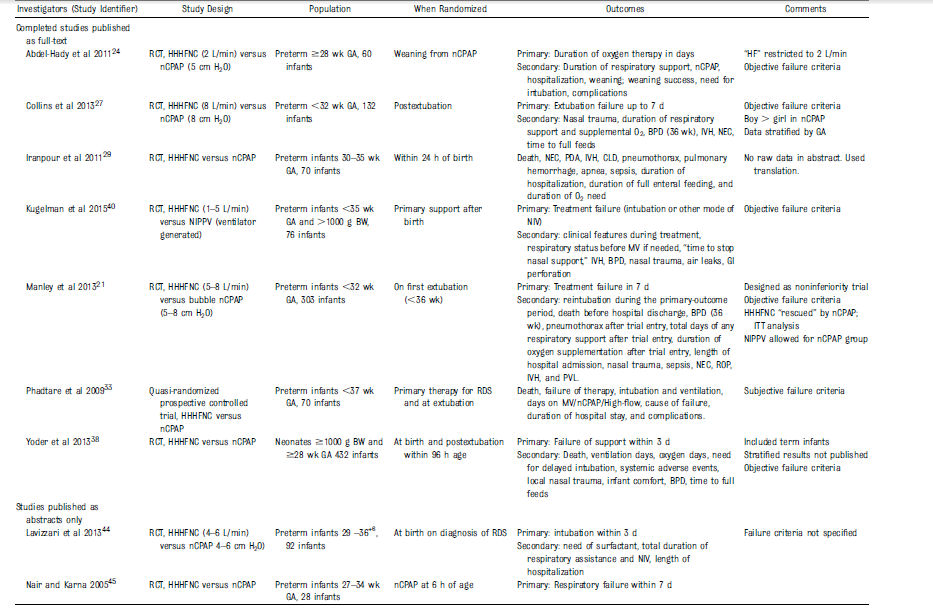
Todos los estudios incluidos compararon
HFNC con nCPAP, excepto uno40 que comparó neonatos en CNAF con
aquellos en VNPPI .
Todos los estudios incluyeron prematuros < 37 s de
gestación, pero sólo 2 estudios incluyeron nacidos con < 32 semanas de gestación.21,27
Un estudio incluyó neonatos a término y prematuros
pero los datos estratificados para recién nacidos prematuros
fueron suministrados por los autores.38 Dos estudios compararon CNAF con nCPAP
tanto como modo primario de soporte respiratorio y como apoyo post
extubación de VM.33,38
Los datos estratificados para prematuros
soportados por CNAF como modo primario ó post extubación estuvieron
disponibles desde los autores para sólo uno de los estudios .38 Por lo tanto, el
análisis final incluyó 6 estudios donde CNAF se comparó con otras formas de
VNI como modo primario de soporte respiratorio. 29,33,38,40,44,45 y 3
estudios en los que se compararon estas 2 modalidades después de extubación
de VM. 21,27,33 Un estudio comparó los dos modos
durante el weaning de soporte respiratorio. 24 Un estudio sólo se publicó como
abstract en Inglés, pero como
artículo de texto completo en Persa. 29 Se usó Google Translate para
obtener una traducción automática desde persa a inglés (Google Inc, Mountain View,
CA). Las características y detalles clínicos de todos los estudios incluidos se
presentan en
Tabla 1.
Riesgo de sesgo en estudios incluídos
Ocho de los estudios eran estudios controlados randomizados mientras que 1 era un estudio clínico cuasi randomizado.33
Hubo
variabilidad del riesgo de sesgo en los estudios incluidos (Figura 2), con 6
estudios con bajo riesgo de sesgo general, 21, 24,27,38,40,45
, 2
estudios con alto riesgo de sesgo debido a métodos publicados poco
claros, 29,33 y 1 tenía información insuficiente en el abstract
como para tener una opinión informada.44
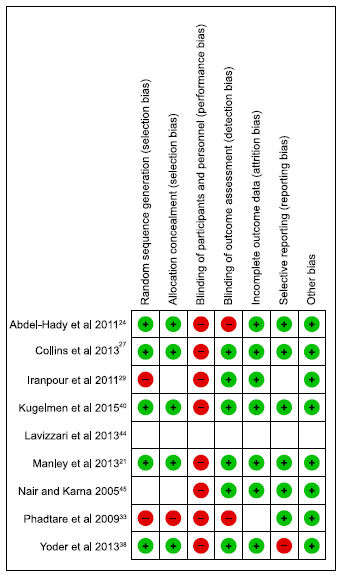
Figura 2.- Diagrama de riesgo de sesgo para cada estudio (representado en eje y izquierdo) como se evaluó en los dominios específicos (representado en eje x superior). Círculos verdes con "+" representan bajo riesgo de sesgo, círculos rojos con "2" representan alto riesgo de sesgo y círculos abiertos representan riesgo de sesgo incierto.
Eficacia de CNAF
La eficacia de CNAF, comparada con otras formas de VNI se evaluó principalmente mediante el análisis de fracaso de la terapia. Debido a que CNAF se ha utilizado tanto como modo primario de soporte respiratorio, así como tambien postextubación de VM en recién nacidos prematuros, se realizaron análisis separados para comparar las tasas de fracaso. Cuatro estudios, que incluyeron 321 recién nacidos prematuros, 38,40,44,45 compararon eficacia de CNAF con otra VNI cuando se usaron como modo primario de soporte respiratorio. Las estimaciones agrupadas de OR para fracaso de terapia para estos estudios fue 1.02 (IC 95%: 0,55 a 1,88; Figura 3A) y 1,12 (0,51 a 2,50) cuando se excluyó el estudio que comparó CNAF y VNPPI 40.
Tres estudios que incluían 661 prematuros 21,27,38 compararon tasas de fracaso de CNAF con la de otra VNI (todos usaron nCPAP) cuando se usó como soporte respiratorio post extubación. El OR agrupado fue 1,09 (0,58 a 2,02; figura 3B), aunque hubo heterogeneidad moderada en los estudios incluídos (I2 = 56%).
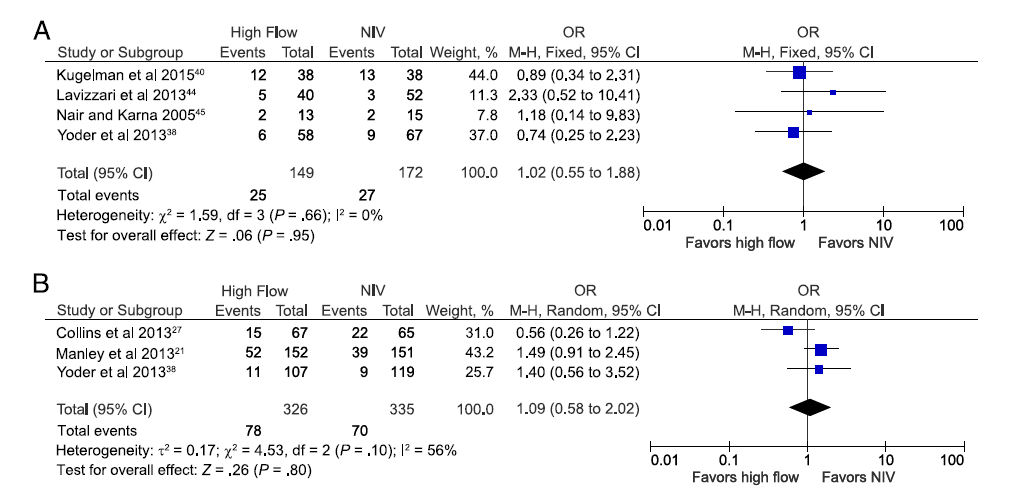
Figura 3.- Estimación agrupada de probabilidades (odds) de fracaso de terapia CNAF en comparación con otros modos de VNI en prematuros, cuando se usa como A) modo primario de asistencia respiratoria y B) después de extubación de VM. Uno de los estudios en el grupo de uso primario tenía un riesgo de sesgo incierto 44; excluyendo éste del análisis dio una estimación combinada de fracaso de 0,85 (0,43 - 1,69).
Cuando todos los 8 estudios elegibles que revelan fracaso de terapia (cualquier definición) fueron incluídos , incluyendo 1.112 recién nacidos prematuros, el OR agrupado de fracaso de terapia para CNAF versus cualquier otra VNI fue 1,10 (0,82 a 1,49; Figura 4A).
Restringiendo este análisis para incluir los 6 estudios con bajo riesgo de sesgo general incluyendo 950 recién nacidos prematuros, el OR agrupado fue 1,09 (0,79 a 1,49; Figura 4B).
Para comparar la eficacia de CNAF versus nCPAP, el estudio que comparó CNAF con VNPPI 40 fue excluido del análisis. Sin embargo, ésto no cambió significativamente la OR (OR para todos los estudios 1.13 [IC del 95%: 0,82 a 1,55] ; OR para los estudios con bajo riesgo de sesgo 1,12 [IC del 95%: 0,80 a 1,56]).
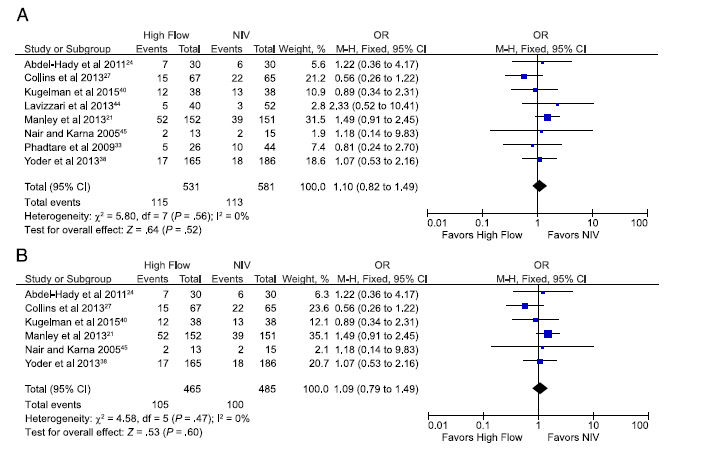
Figura 4.- Estimación agrupada de probabilidades (odds) de fracaso del tratamiento en prematuros apoyados con CNAF en comparación con otros modos de VNI A) incluyendo todos los estudios elegibles y B) los estudios con bajo riesgo de sesgo solamente.
Tal como estaba previsto en el protocolo, se realizó análisis de subgrupos de gestación para las tasas de fracaso de CNAF. Todos los estudios incluidos en esta revisión incluyeron recién nacidos < 32 semanas EG . Sin embargo, datos estratificados en neonatos nacidos < 32 s EG se dispusieron sólo de 3 estudios.21,27,38
Dos estudios compararon eficacia de CNAF con nCPAP post extubación de VM, 21,27 mientras que el tercer estudio utilizó CNAF como soporte primario así como tambien post extubación de VM.38 Combinando todos los datos de estos tres estudios, que incluían 585 infantes, se obtuvo un OR estimado de fracaso de CNAF de 0,89 (0,42-1,89).
Incluyendo sólo los dos estudios que compararon CNAF con nCPAP post extubación (435 neonatos) se obtuvo OR estimado de fracaso de CNAF, en prematuros con < 32 s de 1,12 (0,74-1,69).
Cuatro estudios incluyeron prematuros < 28 semanas EG , 21,27,40,45, mientras que dos más posiblemente incluían < 28 semanas de GA según lo derivado de su tabla de resultados.33,38 Se dispuso de datos estratificados de uno de los estudios anteriores 27 que comparó CNAF con nCPAP post extubación de VM, dando un OR 0,54 (0,19 a 1,53, total 59 recién nacidos). No hubo datos estratificados disponibles de cualquiera de los otros estudios en niños nacidos < 28 s EG.
Para evaluar el tiempo hasta el fracaso del
tratamiento, se compararon las tasas de fracaso a los 3 y 7 días después de
ingreso al estudio. Dos estudios con 443 neonatos , 38,44
reportaron fracaso de
terapia de CNAF versus VNI (ambos nCPAP)
≤
72 horas, con OR agrupado de
1,24 (0,66-2,32; figura 8A
suplementaria).
Cuatro estudios, con un total de 814 recién nacidos,
21,27,38,45 informaron
fracaso de terapia de CNAF versus VNI (todos nCPAP) a los 7 días después de
ingreso al estudio, con OR estimado agrupado de 1,06 (0,75-1,50;
Figura 8B Suplementario ).
En resumen, aunque las tasas de fracaso fueron ligeramente más bajas en el otro grupo de VNI en comparación con CNAF , no fue estadísticamente significativa, independientemente del momento de utilización de CNAF (soporte primario ó post extubación) ó momento de evaluación para fracaso de terapia (3 días ó 7 días).
Seguridad de CNAF
La seguridad se evaluó comparando tasas de muertes y pérdidas de aire pulmonar en recién nacidos soportados por CNAF y por otros modos de VNI. No hubo diferencia estadísticamente significativa en la tasa de muertes en el grupo de prematuros asignados randomizadamente a recibir CNAF en comparación con otros VNI en los 5 estudios que revelan este outcome incluyendo 922 neonatos (OR: 0,48 [0,18-1,24]; Figura 5). 21,24,27,38,40
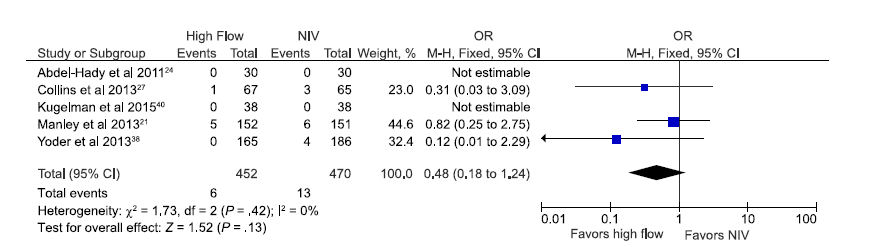
Figura 5.-
Estimación agrupada de odds (probabilidades) de muerte en prematuros soportados
con CNAF en comparación con otros modos de VNI.
Del mismo modo, no se encontraron diferencias estadísticamente significativas entre los grupos en incidencia de fugas de aire pulmonar, según lo reportado por 6 estudios incluyendo 992 recién nacidos prematuros, 21,24,27,33,38,40 con OR 0,72 (0,28 a 1,83; Figura 6).
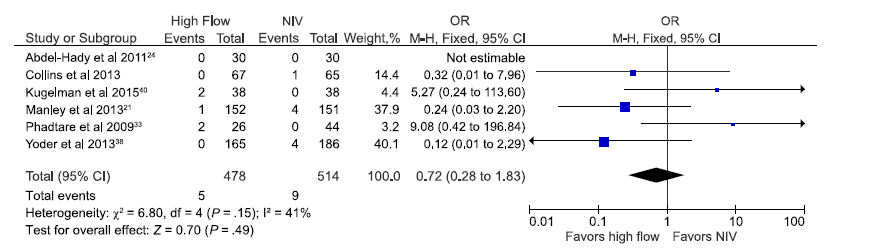
Figura 6.- Estimación agrupada de probabilidades de escape aéreopulmonar en prematuros apoyados con CNAF en comparación con otros modos de VNI.
Trauma nasal
Lesiones de la mucosa nasal ó fosas nasales externas son reportadas con frecuencia en prematuros apoyados por nCPAP.49,50 Cinco estudios incluyendo 857 neonatos 21,29,33,38,40 revelan la incidencia de traumatismo nasal en RN apoyados con CNAF comparados con otras formas de VNI. Un estudio más 26 más reveló trauma nasal, pero como scores más que como eventos y no pudo ser incluído en el análisis. OR agrupado para incidencia de traumatismo nasal en prematuros con CNAF fue 0.13 , lo cual fue significativamente menor (P = 0,02) que los prematuros apoyados con otras formas de VNI (IC 95%: 0,02-0,69; Figura 7), aunque se detectó heterogeneidad significativa entre los estudios . Excluyendo los 2 estudios con alto riesgo de sesgo, OR para traumatismo nasal seguía siendo significativamente menor en neonatos (en total 717) soportados con CNAF (0,33; 0,13 - 0,87; p = 0,02).
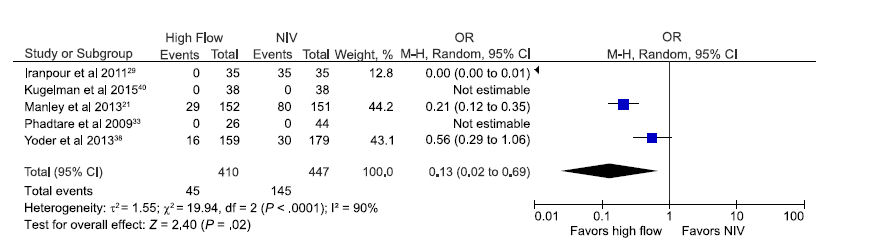
Figura 7.- Estimación agrupada de probabilidades de trauma nasal en prematuros apoyados con CNAF en comparación con otros modos de VNI.
Outcomes secundarios
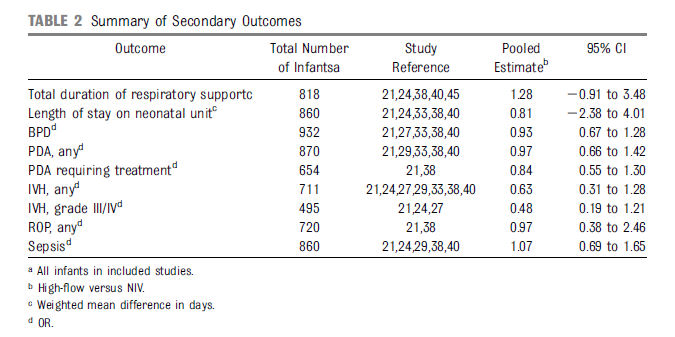
Otros outcomes ó resultados relevantes de prematuros se compararon entre los grupos según como estaba planificado en nuestro análisis (Tabla 2). Los Odds ó probabilidades de todos los outcomes secundarios analizados fueron comparables en los dos grupos de niños.
Tabla 2.- Resumen de outcomes secundarios
Discusión
Según análisis de los auores apoyar a los prematuros con CNAF fue equivalente en eficacia a cualquier otra forma de VNI (VNPPI ó nCPAP). Esta eficacia se observó principalmente en prematuros moderados a tardíos (≥ 28 semanas EG al nacer) y post extubación de VM. CNAF tuvo tasas de fracaso similares a las de otros modos cuando se usó tanto como modo primario de asistencia respiratoria después del nacimiento ó como apoyo post extubación de VM, aunque el número de neonatos incluídos en CNAF al nacer era limitado.
La eficacia se
mantuvo en el tiempo, según la evaluación para fracaso del tratamiento a los 3
días y 7 días después del ingreso al estudio. No hubo diferencias
estadísticamente significativas en los odds ó probabilidades de muerte o fugas de aire
en neonatos apoyado con CNAF en comparación con otros modos de VNI.
Sin embargo, un número significativamente menor de neonatos tuvieron traumatismo nasal
como complicación cuando se apoyaron con CNAF en comparación con otras formas
de VNI.
Los autores evaluaron la eficacia mediante la
comparación de las tasas de fracaso de terapia de un modo particular de
apoyo. "Fracaso de la terapia" fue definido en forma
variable por diferentes estudios.
Seis de los estudios incluídos en el análisis habían publicado criterios
objetivos en los métodos para definir fracaso de terapia, que incluyen una
combinación de criterios clínicos (observación de signos vitales, esfuerzo respiratorio,
apneas, requerimientos de oxígeno) y bioquímicos (características de gases en sangre)
.21 , 24,27,38,40,45 Aunque había pequeñas diferencias en los
umbrales, los criterios publicados por estos estudios fueron muy similares (Tabla
Suplementaria 9). Los otros tres estudios no publicaron criterios objetivos en
sus métodos para definir fracaso de terapia.29,33,44 estos 3
estudios se considera que tienen un alto riesgo de sesgo de realización y
detección. Sin embargo, en el análisis por separado,
incluyendo y excluyendo los estudios con alto riesgo de sesgo, el OR (odd ratio) agrupado
para fracaso de terapia sigue siendo muy similar (ver sección de resultados
"eficacia de terapia"). Sin embargo, es importante que futuros estudios
intente definir "fracaso" con más precisión y de manera uniforme, para que los
resultados sean fácilmente comparables entre los diferentes estudios.
Los estudios con bajo riesgo de sesgo (Figura 4B) definen fracaso de terapia por criterios objetivos. Sin embargo, no todas las fallas resultaron necesariamente en reintubación para VM, 26,27 lo que sugiere que "fracaso de un modo de VNI" no es lo mismo que "fracaso de VNI." En nuestra opinión, esta es una distinción importante que hacer, ya que en general la comunidad neonatal parece estar avanzando hacia un mayor uso de la VNI, que ha mostrado beneficio clínico. 5
Una definición de Fracaso basada en tiempo tiene sus
desventajas, ya que algunos neonatos siguen "a prueba", incluso después del
período de estudio definido, 51 en especial el grupo de prematuros extremos.
Una complicación común entre los prematuros soportados con nCPAP es la lesión nasal,
49 que puede variar desde 20 a 60%. Las tasas más altas
se observaron en los prematuros más pequeños y extremos. El presente
estudio sugiere probabilidades significativamente menores de traumatismo nasal
(definido y medido en forma variable) en prematuros
soportados con CNAF , en comparación con otros modos de nCPAP. Además, las
matronas neonatales creen que los
prematuros están más cómodos en CNAF en
comparación con nCPAP, 52 aunque no se detectó ninguna diferencia en la
comodidad del paciente, mientras estaban con CNAF en comparación con nCPAP en un
estudio reciente.30
CNAF es el modo más reciente de VNI en pacientes adultos y neonatales. Sin embargo, el mecanismo exacto de acción, que causa beneficio clínico, no se ha evaluado completamente. Teorías propuestas incluyen lavado del espacio muerto anatómico en las vías respiratorias superiores debido al flujo de gas, mejora en la conductancia de gas debido a la humidificación, reducción de las demandas metabólicas de las vías respiratorias por gas caliente y humidificado y suministro de presión de distensión a los pulmones .9,53 El espacio muerto anatómico extratorácico está relacionado con la edad y es mayor en prematuros pequeños (0,3 ml / kg) en comparación con adultos.54 Así, el lavado continuo de este espacio relativamente grande con un suministro de gas fresco podría ser de beneficio clínico , especialmente en el período neonatal. En contraste con nCPAP (ó BiPAP), que dependen de un sello para proporcionar presión de distensión, un sello en las vías respiratorias superiores no es necesario para CNAF . Por lo tanto, la presión de distensión proporcionada por CNAF es dinámica, dependiendo de la fase del ciclo respiratorio.55,56
Todos estos mecanismos, en teoría, sugieren que CNAF puede ser adecuada a la anatomía y la fisiología de los prematuros. Además, CNAF parece causar menos trauma menos nasal en prematuros y parece ser preferido por matronas 52 y padres.30 Sin embargo, debido a la fisiología de los pulmones en el síndrome de distrés respiratorio precoz (SDR), la presión de distensión continua proporcionada por nCPAP, en teoría, podría hacerlo más adecuado como modo de asistencia respiratoria que CNAF.
Sistemas CNAF han sido usados en adultos y lactantes desde principios del 2000. A nuestro conocimiento, esta es la primera revisión sistemática detallada comparando CNAF con otros modos de VNI en prematuros, con el fin de juntar todos los datos y proporcionar base de evidencia para este modo popular de apoyo respiratorio.
A excepción de uno, todos los estudios en este metanálisis han comparado CNAF con nCPAP. Aunque nuestro análisis demostró probabilidades (odds) de fracaso de CNAF levemente más altos en comparación con nCPAP y con todos los demás modos de VNI combinados, ésto no fue estadísticamente significativo. La mayoría de los recién nacidos incluídos en los estudios en el presente análisis eran prematuros moderados (28-32 semanas GA) a tardíos (> 32 semanas EG) .
Sólo 4 de los estudios en nuestro análisis incluyeron prematuros < 28 semanas al nacer, 21,27,40,45 y los 2 estudios grandes utilizaron CNAF a esta EG sólo después de extubación.21,27
El estudio de Nair y Karna45 utilizó CNAF como modo primario de apoyo en prematuros < 28 s EG pero no hay datos estratificados disponibles para estos niños. Collins y cols 27 reportaron reintubación de neonatos < 28 semanas EG, la cual fue comparable entre los grupos CNAF y nCPAP.
El estudio de Manley y cols 21 reveló tasas de fracaso más altas para neonatos nacidos con < 26 semanas EG (81% para CNAF en comparación con 61% para nCPAP). Por lo tanto, la evidencia de la eficacia de CNAF en prematuros extremos ( < 28 semanas EG al nacer), en comparación con otros modos de VNI sigue siendo escasa y esto debe ser objeto de futuros estudios. Hasta entonces, esta forma de soporte respiratorio no se puede recomendar en recién nacidos prematuros extremos, ya sea como soporte primario ó post extubación.
La principal limitación del presente estudio es que no se pudo llevar a cabo análisis estratificado adecuado en las EG más bajas , como se planificó en nuestros métodos. Esto se debe a la cantidad limitada de datos sobre uso de CNAF en neonatos < 32 s EG y más aún en recién nacidos < 28 semanas EG. La gran mayoría de prematuros < 28 s al nacer necesitan algún tipo de asistencia respiratoria, tanto al nacer como post extubación. Más aún, estos son los prematuros en mayor riesgo de traumatismo nasal 49 que causa deformidades nasales a largo plazo, 57 y si CNAF demuestra ser eficaz en prematuros extremos la incidencia de este tipo de deformidades podría minimizarse.
Debido al diseño de nuestro estudio, hemos incluído estudios con alto riesgo de sesgo en sus métodos, así como estudios publicados como abstracts ó resúmenes solamente. A lo largo del artículo, los autores presentan resultados incluyendo y excluyendo estudios con alto riesgo de sesgo, como parte del análisis de sensibilidad. Los resultados revelan que el tamaño del efecto ó la significación estadística no cambiaron en el análisis de sensibilidad. Aunque estamos seguros de nuestros métodos científicos, es nuestra opinión que la práctica clínica debe estar basada en datos de estudios con bajo riesgo de sesgo.
Los resultados de nuestro análisis sugieren que CNAF no es inferior a otros modos de NIV en recién nacidos prematuros. Debido a las probabilidades significativamente menores de trauma nasal y a que no hay diferencias significativas en otros resultados neonatales comunes, CNAF puede ser un método preferido en este grupo EG. Se debe tener precaución en los más prematuros donde la eficacia y seguridad de CNAF , sea como modo primario de apoyo o después de extubación, aún no están completamente probadas.
La investigación futura debe concentrarse
en el grupo de prematuros extremos , quienes se beneficiarían más de los
modos de VNI. El weaning de VNI es otra área de práctica que requiere más
investigación, dado que una revisión reciente sobre weaning de CNAF en prematuros no
logró identificar ningún estudio elegible sobre este aspecto. 58
Los autores sienten que sus datos proporcionan evidencia para considerar CNAF como
modo de asistencia respiratoria en recién nacidos prematuros por los clínicos.
Abreviaturas
BiPAP: bilevel nasal continuous positive airway pressure
BPD: bronchopulmonary dysplasia
BW: birth weight
CI: confidence interval
GA: gestational age
HHHFNC: heated humidified highflow nasal cannula
IVH: intraventricular hemorrhage
MeSH: Medical Subject Headings
MV: mechanical ventilation
nCPAP: nasal continuous positive airway pressure
NEC: necrotizing enterocolitis
NIPPV: noninvasive positive pressure ventilation
NIV: noninvasive ventilation
OR: odds ratio
PDA: patent ductus arteriosus
RDS: respiratory distress syndrome
ROP: retinopathy of prematurity
Referencias
Stoll BJ, Hansen NI, Bell EF, et al; Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 2010;126(3):443–456
Costeloe KL, Hennessy EM, Haider S, Stacey F, Marlow N, Draper ES. Short term outcomes after extreme preterm birth in England: comparison of two birth cohorts in 1995 and 2006 (the EPICure studies). BMJ. 2012;345:e7976
Morley CJ, Davis PG, Doyle LW, Brion LP, Hascoet JM, Carlin JB; COIN Trial Investigators. Nasal CPAP or intubation at birth for very preterm infants. N Engl J Med. 2008;358(7):700–708
Finer NN, Carlo WA, Walsh MC, et al; SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network. Early CPAP versus surfactant in extremely preterm infants. N Engl J Med. 2010;362(21):1970–1979
Schmölzer GM, Kumar M, Pichler G, Aziz K, O’Reilly M, Cheung PY. Non-invasive versus invasive respiratory support in preterm infants at birth: systematic review and meta-analysis. BMJ. 2013;347: f5980
Davis PG, Henderson-Smart DJ. Nasal continuous positive airways pressure immediately after extubation for preventing morbidity in preterm infants. Cochrane Database Syst Rev. 2003; (2): CD000143
Kirpalani H, Millar D, Lemyre B, Yoder BA, Chiu A, Roberts RS; NIPPV Study Group. A trial comparing noninvasive ventilation strategies in preterm infants. N Engl J Med. 2013;369(7):611–620
Lemyre B, Davis PG, De Paoli AG, Kirpalani H. Nasal intermittent positive pressure ventilation (NIPPV) versus nasal continuous positive airway pressure (NCPAP) for preterm neonates after extubation. Cochrane Database Syst Rev. 2014;9:CD003212
Ward JJ. High-flow oxygen administration by nasal cannula for adult and perinatal patients. Respir Care. 2013;58(1):98–122
Manley BJ, Owen L, Doyle LW, Davis PG. High-flow nasal cannulae and nasal continuous positive airway pressure use in non-tertiary special care nurseries in Australia and New Zealand. J Paediatr Child Health. 2012;48(1):16–21
Ojha S, Gridley E, Dorling J. Use of heated humidified high-flow nasal cannula oxygen in neonates: a UK wide survey. Acta Paediatr. 2013;102(3):249–253
Nath P, Ponnusamy V, Willis K, Bissett L, Clarke P. Current practices of high and low flow oxygen therapy and humidification in UK neonatal units. Pediatr Int. 2010;52(6):893–894
Hochwald O, Osiovich H. The use of high flow nasal cannulae in neonatal intensive care units: Is clinical practice consistent with the evidence? J Neonatal Perinatal Med. 2010;3(3):187–191
Shetty S, Greenough A. Review finds insufficient evidence to support the routine use of heated, humidified highflow nasal cannula use in neonates. Acta Paediatr. 2014;103(9):898–903
Lee JH, Rehder KJ, Williford L, Cheifetz IM, Turner DA. Use of high flow nasal cannula in critically ill infants, children, and adults: a critical review of the literature. Intensive Care Med. 2013; 39(2):247–257
Manley BJ, Dold SK, Davis PG, Roehr CC. High-flow nasal cannulae for respiratory support of preterm infants: a review of the evidence. Neonatology. 2012;102(4): 300–308
Jobe AH, Bancalari E. Bronchopulmonary dysplasia. Am J Respir Crit Care Med. 2001;163(7):1723–1729
Papile LA, Burstein J, Burstein R, Koffler H. Incidence and evolution of subependymal and intraventricular hemorrhage: a study of infants with birth weights less than 1,500 gm. J Pediatr. 1978;92(4):529–534
Bell MJ, Ternberg JL, Feigin RD, et al. Neonatal necrotizing enterocolitis. Therapeutic decisions based upon clinical staging. Ann Surg. 1978;187(1): 1–7
Walsh MC, Kliegman RM. Necrotizing enterocolitis: treatment based on staging criteria. Pediatr Clin North Am. 1986;33(1):179–201
Manley BJ, Owen LS, Doyle LW, et al. Highflow nasal cannulae in very preterm infants after extubation. N Engl J Med. 2013;369(15):1425–1433
Hozo SP, Djulbegovic B, Hozo I. Estimating the mean and variance from the median, range, and the size of a sample. BMC Med Res Methodol. 2005;5:13
Kotecha SJ, Edwards MO, Watkins WJ, et al. Effect of preterm birth on later FEV1: a systematic review and metaanalysis. Thorax. 2013;68(8):760–766
Abdel-Hady H, Shouman B, Aly H. Early weaning from CPAP to high flow nasal cannula in preterm infants is associated with prolonged oxygen requirement: a randomized controlled trial. Early Hum Dev. 2011;87(3):205–208
Campbell DM, Shah PS, Shah V, Kelly EN. Nasal continuous positive airway pressure from high flow cannula versus Infant Flow for Preterm infants. J Perinatol. 2006;26(9):546–549
Collins CL, Barfield C, Horne RS, Davis PG. A comparison of nasal trauma in preterm infants extubated to either heated humidified high-flow nasal cannulae or nasal continuous positive airway pressure. Eur J Pediatr. 2014; 173(2):181–186
Collins CL, Holberton JR, Barfield C, Davis PG. A randomized controlled trial to compare heated humidified high-flow nasal cannulae with nasal continuous positive airway pressure postextubation in premature infants. J Pediatr. 2013; 162(5):949–954
de Jongh BE, Locke R, Mackley A, et al. Work of breathing indices in infants with respiratory insufficiency receiving highflow nasal cannula and nasal continuous positive airway pressure. J Perinatol. 2014;34(1):27–32
Iranpour R, Sadeghnia A, Hesaraki M. High-flow nasal cannula versus nasal continuous positive airway pressure in the management of respiratory distress syndrome. J Isfahan Med School. 2011; 29(143):761–771
Klingenberg C, Pettersen M, Hansen EA, et al. Patient comfort during treatment with heated humidified high flow nasal cannulae versus nasal continuous positive airway pressure: a randomised cross-over trial. Arch Dis Child Fetal Neonatal Ed. 2014;99(2):F134–F137
Lavizzari A, Veneroni C, Colnaghi M, et al. Respiratory mechanics during NCPAP and HHHFNC at equal distending pressures. Arch Dis Child Fetal Neonatal Ed. 2014;99(4):F315–F320
Miller SM, Dowd SA. High-flow nasal cannula and extubation success in the premature infant: a comparison of two modalities. J Perinatol. 2010;30(12): 805–808
Phadtare R, Joshi R, Rajhans A, Patil S, Dominic S, Devaskar U. High flow nasal cannula oxygen (Vapotherm) in premature neonates with respiratory distress syndrome: is it better than the conventional nasal continuous positive airway pressure (NCPAP)? Perinatology. 2009;11(1):8
Roberts CT, Dawson JA, Alquoka E, et al. Are high flow nasal cannulae noisier than bubble CPAP for preterm infants? Arch Dis Child Fetal Neonatal Ed. 2014; 99(4):F291–F295
Saslow JG, Aghai ZH, Nakhla TA, et al. Work of breathing using high-flow nasal cannula in preterm infants. J Perinatol. 2006;26(8):476–480
Sreenan C, Lemke RP, Hudson-Mason A, Osiovich H. High-flow nasal cannulae in the management of apnea of prematurity: a comparison with conventional nasal continuous positive airway pressure. Pediatrics. 2001;107(5):1081–1083
Woodhead DD, Lambert DK, Clark JM, Christensen RD. Comparing two methods of delivering high-flow gas therapy by nasal cannula following endotracheal extubation: a prospective, randomized, masked, crossover trial. J Perinatol. 2006;26(8):481–485
Yoder BA, Stoddard RA, Li M, King J, Dirnberger DR, Abbasi S. Heated, humidified high-flow nasal cannula versus nasal CPAP for respiratory support in neonates. Pediatrics. 2013; 131(5). Available at: www.pediatrics.org/ cgi/content/full/131/5/e1482
Collins CL, Holberton JR, König K. Comparison of the pharyngeal pressure provided by two heated, humidified highflow nasal cannulae devices in premature infants. J Paediatr Child Health. 2013;49(7):554–556
Kugelman A, Riskin A, Said W, Shoris I, Mor F, Bader D. A randomized pilot study comparing heated humidified high-flow nasal cannulae with NIPPV for RDS. Pediatr Pulmonol. 2015;50(6):576–583
Hough J, Shearman A, Jardine L. Humidified high flow nasal cannula in preterm infants: a trial of randomised flow rate on cardiorespiratory parameters. In: Pediatric Academic Societies Annual Meeting; April 28–May 1, 2012; Boston, MA
Hua C, McEwan A, Callander I. Hiflow compared to CPAP from 30 weeks gestation at Liverpool hospital. J Paediatr Child Health. 2013;49:131 [conference abstract]
Joshi RRA, Patil S, Dominic S, Phadtare R, Devaskar U. High flow oxygen in neonatal respiratory failure: is it better than CPAP. In: Pediatric Academic Societies Annual Meeting; May 3–6, 2008; Honolulu, HI
Lavizzari ACM, Mercadante D, Pierro M, Mosca F. High flow nasal cannula versus nasal CPAP in the management of respiratory distress syndrome: preliminary data. In: Pediatric Academic Societies Annual Meeting; May 3–7, 2013; Washington, DC
Nair G, Karna P. Comparison of the effects of Vapotherm and nasal CPAP in respiratory distress in preterm infants. In: Pediatric Academic Societies Annual Meeting; May 14–17, 2005; Washington, DC
Ovalle OO, Gomez T, Troncoso G, Palacios J, Ortiz E. High flow nasal cannula after surfactant treatment for infant respiratory distress syndrome in preterm infants ,30 weeks. In: Pediatric Academic Societies Annual Meeting; May 14–17, 2005; Washington, DC
Pyon KH, Aghai ZH, Nakhla TA, Stahl GE, Saslow JG. High Flow Nasal Cannula in Preterm Infants: Effects of High Flow Rates on Work of Breathing. Pediatric Academic Society; 2008
Yang CY, Lien R, Yang PH, Chiang MC, Chu SM. Weaning of the ventilatory support in VLBW infants: the role of peep, O2 flow and high flow air. In: 50th Annual Meeting of the European Society for Paediatric Research; October 9–12, 2009; Hamburg, Germany
Newnam KM, McGrath JM, Estes T, Jallo N, Salyer J, Bass WT. An integrative review of skin breakdown in the preterm infant associated with nasal continuous positive airway pressure. J Obstet Gynecol Neonatal Nurs. 2013;42(5): 508–516
Fischer C, Bertelle V, Hohlfeld J, Forcada- Guex M, Stadelmann-Diaw C, Tolsa JF. Nasal trauma due to continuous positive airway pressure in neonates. Arch Dis Child Fetal Neonatal Ed. 2010;95(6):F447–F451
Giaccone A, Jensen E, Davis P, Schmidt B. Definitions of extubation success in very premature infants: a systematic review. Arch Dis Child Fetal Neonatal Ed. 2014; 99(2):F124–F127
Roberts CT, Manley BJ, Dawson JA, Davis PG. Nursing perceptions of high-flow nasal cannulae treatment for very preterm infants. J Paediatr Child Health. 2014;50(10):806–810
Dysart K, Miller TL, Wolfson MR, Shaffer TH. Research in high flow therapy: mechanisms of action. Respir Med. 2009; 103(10):1400–1405
Numa AH, Newth CJ. Anatomic dead space in infants and children. J Appl Physiol (1985). 1996;80(5):1485–1489
Mündel T, Feng S, Tatkov S, Schneider H. Mechanisms of nasal high flow on ventilation during wakefulness and sleep. J Appl Physiol (1985). 2013;114(8): 1058–1065
Parke R, McGuinness S, Eccleston M. Nasal high-flow therapy delivers low level positive airway pressure. Br J Anaesth. 2009;103(6):886–890
Li Y, Sepulveda A, Buchanan EP. Late presenting nasal deformities after nasal continuous positive airway pressure injury: 33-year experience. J Plast Reconstr Aesthet Surg. 2015;68(3): 339–343
Farley RC, Hough JL, Jardine LA. Strategies for the discontinuation of humidified high flow nasal cannula (HHFNC) in preterm infants. Cochrane Database Syst Rev. 2015;6:CD011079