Budesonida /Surfactante para prevenir Displasia broncopulmonar
Enero 2016
Administración
intratraqueal de Budesonide/Surfactante para prevenir Displasia
Broncopulmonar
Tsu F. Yeh
Department of Pediatrics, National Taiwan University Hospital, National Taiwan
University College of Medicine, Taipei, Taiwan
American Journal of Respiratory and Critical Care Medicine Enero 2016
Traducción libre Dr Mauricio Marín Pediatra Puerto Montt Chile
La displasia broncopulmonar (DBP) es la
complicación pulmonar más importante después de ventilación mecánica en
prematuros. Varias estrategias que incluyen el uso de vitamina A y cafeína se ha
reportado que son beneficiosas para DBP (1-3). Sin embargo, no hay
una terapia
definitiva que pueda eliminar esta complicación.
Aunque el mecanismo no está completamente claro, se cree que la inflamación
pulmonar juega un rol central en la patogénesis. La dexametasona es una de las
terapias más efectivas para prevenir ó tratar la DBP. Sin embargo, el
tratamiento con
dexametasona sistémica no se recomienda en general debido a efectos adversos a
largo plazo (4, 5). La administración inhalada de glucocorticoides a prematuros
es técnicamente difícil y sus efectos son limitados (6-8). Por lo tanto, es
importante encontrar un tratamiento que reduzca los efectos adversos
sistémicos de los glucocorticoides mientras que al mismo tiempo mantenga los
efectos antiinflamatorios locales en el pulmón.
La budesonida es un glucocorticoide con fuertes efectos antiinflamatorios
locales. Un estudio piloto mostró que la instilación intratraqueal de budesonida,
usando surfactante como vehículo, mejoró significativamente el status pulmonar
(9). Por tanto, se realizó un estudio multicéntrico, randomizado para
determinar si la administración intratraqueal precoz de budesonida / surfactante
puede disminuir la incidencia de displasia broncopulmonar o muerte. Algunos de
los resultados de estos estudios han sido reportados previamente en forma de
resúmenes (abstracts) y una presentación de plataforma en la reunión de las
Sociedades Académicas de Pediatría (4 - 7 mayo 2013, Washington, DC) y en un
congreso de la Academia Europea de Sociedades de Pediatría ( 17-21 oct 2014,
Barcelona, España) (10, 11).
Métodos
Población en estudio
Entre 01 de abril 2009 y 1 de marzo de 2013, todos los recién nacidos con
dificultad respiratoria poco después del nacimiento fueron evaluados para
elegibilidad para el estudio en tres centros terciarios: John H. Stroger, Jr.
Hospital of Cook County (JSH, Chicago, IL), National Taiwan University Hospital
(NTUH, Taipei, Taiwan) y China Medical University Hospital (CMUH, Taichung,
Taiwan).
Los criterios de inclusión fueron determinados dentro de 4 horas después del nacimiento e incluyen :
Peso al nacer inferior a 1500 g
Evidencia radiográfica de Enfermedad po déficit de surfactante grave (EDS) (grados III-IV) (12)
Ventilación mecánica
FiO2 de al menos 0,5
Ausencia de anomalías congénitas graves ó malformación cardiopulmonar incompatible con la vida.
Estos RN fueron
considerados con alto riesgo de desarrollar DBP. El estudio fue aprobado
por el Comité de Etica de cada institución participante. Se obtuvo un
consentimiendo informado verbal de la madre antes del parto y luego
escrito dentro de 4 horas posterior al parto cuando los criterios de inclusión
fueron determinados.
Instilación Intratraqueal de Budesonida/Surfactante
Los RN fueron randomizados en un grupo de intervención ó en un grupo control, basados en una lista de asignación realizada por un estadístico. Una randomización oculta fue generada por una computadora con bloques permutados en tamaños aleatorios de dos, cuatro, seis y ocho para mantener el equilibrio. Una lista de las asignaciones de los pacientes se le dió a cada hospital participante, con la mitad de los RN asignados al grupo de intervención y la otra mitad al grupo control en cada hospital.
Cuando la primera dosis fuera a ser indicada, el investigador principal en el hospital participante abriría la lista de asignaciones y prepararía la jeringa apropiada. El grupo control recibió sólo surfactante (Survanta, 100 mg ó 4 ml/kg, Abbott Laboratories) y el grupo intervención recibió surfactante (100 mg or 4 ml/kg) y budesonida (Pulmicort , suspensión para nebulización , Aztra Zeneca) 0,25 mg ó 1 ml/kg.
Esta dosis proporciona una concentración de surfactante a budesonida mayor de 50:1; esta mezcla fue evaluada en un estudio in vitro usando un medidor de surfactante (surfactómetro) y un cromatógrafo líquido de alto - rendimiento y demostró que no altera las propiedades biofísicas y químicas del surfactante.
Excepto por una diferencia en volumen, la solución en cada jeringa fué clara e indistinguible. La jeringa fue cubierta con una cinta adhesiva que impedía identificar el volumen de la solución. Los principales investigadores eran directores de división ó un consultor de experiencia; ellos supervisaron y raramente tuvieron directa responsabilidad en el tratamiento del paciente en la unidad de cuidados intensivos neonatal (UCIN).
Antes de la instilación intratraqueal, la
jeringa fue suavemente agitada y el surfactante ó la mezcla surfactante/budesonida
fue administrado de manera similar a la terapia de surfactante de rutina.
Administraciones repetidas de surfactante/budesonida ó surfactante solo fueron
dadas cada 8 horas a RN en el grupo de intervención ó grupo control hasta que
requirieron una FiO2 < 0.3, fueron extubados ó recibieron un máximo de 6
dosis.
Cuidado Respiratorio
Durante el estudio, solo el investigador principal estaba en conocimiento de los
contenidos de las jeringas. El médico tratante de UCIN, los médicos y matronas
del Servicio de Neonatología que estaban a cargo diariamente del cuidado
neonatal estaban ciegos a la asignación del estudio. Una guía general para el
manejo de EDS y administración de volumen fue seguida como se describe
previamente.9 Para los neonatos que presentaron dificultad respiratoria poco
después del nacimiento, se inició un intento de CPAP nasal en sala de partos y
los
RN con severa retracción ó pobre esfuerzo respiratorio fueron intubados. El objetivo
de la terapia de ventilación en UCIN fue mantener una saturación de O2 90-95%, pCO2 no mayor de 50 mmHg y pH no menor de 7,2.
Los RN que no respondieron adecuadamente a CPAP
(FiO2 ≥ 0,6 y saturación de O2 < 85%) fueron intubados. La guía de manejo
respiratorio se enfocó en las indicaciones para uso de O2 por halo, cánula nasal, CPAP,
ventilación mandatoria intermitente (VMI) ó ventilación de alta frecuencia
oscilatoria (VAFO)
y en el weaning ó destete de ventilación mecánica. A los RN que no pudieron tolerar aire
ambiental u oxígenoterapia a través de halo se les indicó una cánula nasal ó CPAP según necesidad. Durante el estudio,
los autores definieron "oxígenoterapia
asistida" como requerimiento de cualquiera de las siguientes: cánula nasal, CPAP,
VMI ó VAFO.
Mediciones de gases arteriales y del estado ácido base fueron obtenidas cada
mañana antes de la visita médica en la UCIN.
No se dió Óxido nítrico a Recién nacidos de muy bajo peso de nacimiento durante el período del estudio. Indometacina fue dada a RN que tenían Ductus arterioso persistente significativo, definido y descrito previamente.13 La dexametasona sistémica postnatal fue reservada sólo para RN que tuvieron enfermedad pulmonar severa subyacente con falla respiratoria intratable (recibiendo VMI (ventilación mecánica invasiva) con FiO2 100% ó VAFO) . En tales casos, un curso corto de dexametasona (3 a 5 dosis de 0.25 mg/kg cada 12 horas) fué dado a discreción del médico tratante.
Mediciones de Outcome (resultados)
El diagnóstico de DBP fue hecho por el médico tratante si el neonato había tenido distrés respiratorio continuo desde el nacimiento y requerimiento de oxígeno suplementario (FiO2 > 21%) a las 36 semanas de edad gestacional corregida. El resultado fue informado a un observador independiente externo que estaba ciego a la asignación del paciente.14 Esta definición fue usada en este estudio porque fue considerada un mejor predictor de resultado pulmonar anormal para neonatos de muy bajo peso de nacimiento. Al momento de diseñar este estudio a principios de 2009, los autores usaron esta definición por dos razones : 1) esta definición había sido usada por muchos años en las unidades de los autores y su personal médico y de matronería estaban familiarizados con esta definición y 2) esta definición proporcionaría la oportunidad de comparar la incidencia de DBP con nuestro estudio previo 9 y con otros importantes estudios publicados por otros investigadores. (2, 3, 15–17)
Debido a la EDS (enfermedad por déficit de surfactante) severa y radiológicamente evidente poco después del nacimiento y debido al distrés respiratorio continuo desde el nacimiento, los RN de los autores, lo más probable es que tuvieran una enfermedad pulmonar subyacente bien establecida al momento del diagnóstico de displasia broncopulmonar. Al final de este estudio se realizó tambien un análisis post hoc , basado en la actual definición dada por el Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD, Bethesda, MD), para RN con menos de 32 semanas de gestación.1 Esta definición está basada en la severidad . En esta definición , un RN que requiere oxígeno suplementario a los 28 días de edad cronológica pero que no requiere oxígeno adicional a las 36 semanas de edad gestacional se considera como DBP leve. La DBP moderada está definida como la necesidad de oxígeno menor a 30% y la DBP severa está definida como la necesidad de oxígeno de al menos 30% a las 36 semanas de edad gestacional.
En aspirado traqueal se analizaron 18 niveles de interleucinas (IL-1, IL-6 e IL-8) usando un kit comercial ELISA a las 12 horas, 24 horas y entre 3 - 5 y 7 - 8 días después de iniciado el estudio en los primeros 40 R Nacidos.
Estudio de Seguimiento
Se realizó un estudio de seguimiento cuando los pacientes tenían 2 a 3 años de
edad. En cada visita, se realizó una anamnesis y un examen físico y neurológico
completo que incluyó coordinación, reflejos y tono muscular. Las alteraciones
neuromotoras fueron clasificadas como leves, moderadas ó severas, basadas en la
movilidad del niño como está descrito por Costello y colegas.19 Una evaluación
mental y psicomotriz fue realizada usando la escala de Bayley (BSID-II). Se
evaluó retraso en el neurodesarrollo según como fue definido y descrito por Stoll y
cols. 20
Análisis Estadístico
Antes que los datos fueran analizados, el observador externo independiente
evaluaría y verificaría otra vez los criterios de inclusión y exclusión y el
diagnóstico de DBP de cada RN. El resultado principal evaluado fue la incidencia
de DBP ó muerte.
Nuestra experiencia previa indicaba que cerca de un 60% de los RN que cumplían
los criterios de inclusión desarrollarían DBP ó morirían. Los autores hipotetizaron
que 60% en el grupo control y 40% en el grupo de intervención
desarrollarían DBP ó morirían. Al permitir un 5% de probabilidad de error tipo I
y un 10% de error tipo II, el número requerido en cada grupo sería de 130.
21 Un
estimado de 140 pacientes fue considerado un número adecuado para cada grupo.
Los resultados secundarios evaluados fueron mediadores antiinflamatorios en
aspirados traqueales. Se evaluaron los efectos adversos inmediatos como cambios en
electrolitos séricos, glucosa, nitrógeno ureico, presión arterial y cambios en
el crecimiento físico. Se evaluó también la
incidencia de hemorragia intraventricular, enterocolitis necrotizante,
retinopatía de la prematuridad severa (≥ grado III), sepsis clínica
ó bacteriemia. Se realizó
ecografía y fondo de ojo según calendarización de la unidad de neonatología para
todos los RN menores de 1500 g. Mortalidad, DBP, requerimiento de oxígeno y
número de dosis de surfactante también fueron exploradas.
Todos los análisis fueron desarrollados de acuerdo al principio intención de
tratar, asignándoles un valor a los datos faltantes por el método de “última
observación llevada hacia adelante”. Además, se realizó un análisis de
sensibilidad mediante la aplicación de múltiples asignaciones de valores para
los datos faltantes. Los resultados, usando múltiples asignación de valores
fueron similares porque faltaban pocas observaciones. Los resultados basados en
el método de “última observación llevada hacia adelante” fueron más
conservadores y así fueron presentados.
La media y la desviación estándar
fueron reportadas para las variables continuas y el número y porcentaje fueron
reportados para las variables categóricas. El test del X2 y el Test exacto de
Fisher fueron usadas para variables categóricas incluyendo
muerte, DBP, DBP ó muerte y severidad de la DBP. La razón de riesgo se calculó
como relación ó razón de tasas de incidencia acumulada de evento que ocurre en grupo
tratado con budesonida con el grupo control y número necesario a
tratar como el inverso de esas dos tasas de incidencia acumulada. Para las
variables continuas, los valores de media en cada momento y en cada grupo para
variables tales como FiO2, PaO2, PaCO2, pH, Índice de Oxigenación y presión media de
vía aérea fueron derivados de un modelo lineal generalizado con ecuaciones de
estimación generalizadas y las diferencias en los valores a través del tiempo se
compararon entre los dos grupos. 22
Las ecuaciones de estimación generalizadas
fueron usadas para dar cuenta de la dependencia entre los resultados de los
participantes en diferentes momentos. Un test de Rangos
de Wilcoxon fue utilizado para comparar niveles de interleucinas en aspirado
traqueal entre los dos grupos. Se generaron gráficos de incidencia acumulativa
de Kaplan-Meier para
mostrar el “tiempo hasta el evento” de extubación y weaning a aire ambiental. Un
análisis post hoc del outcome primario fue realizado para ajustar para
esteroides prenatales, puntaje de Apgar y corioamnionitis. No se hicieron
ajustes para outcomes
secundarios y efectos adversos inmediatos. Todos los
valores P fueron de dos caras y se consideró una P significativa si ésta era
menor de 0,05.
Resultados
Población en Estudio
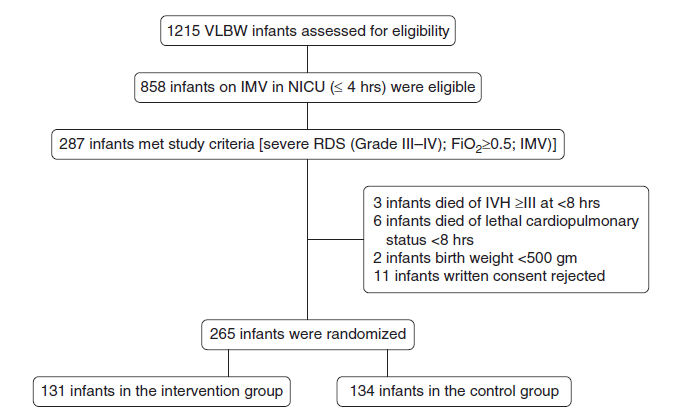
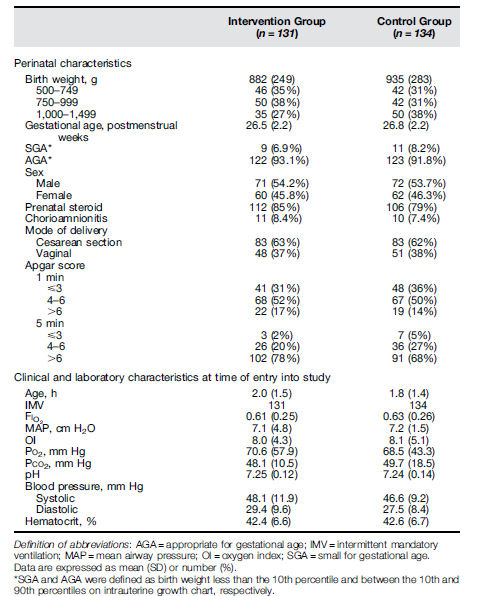
Durante el período del estudio, 1.215 RN de muy bajo peso de nacimiento fueron tratados por EDS al nacer, 858 RN requirieron intubación dentro de 4 horas de nacidos y fueron ingresados a UCIN. El número final para el análisis fue de 265 : 131 en el grupo de intervención y 134 en el grupo control (Figura 1). Los datos basales de los pacientes (Tabla 1) fueron comparables entre ambos grupos.

Figura 1.- Distribución de pacientes. IMV = ventilación mandatoria intermitente; IVH = hemorragia intraventricular; UCIN = unidad de cuidados intensivos neonatales; SDR = síndrome de dificultad respiratoria ; MBPN = muy bajo peso al nacer.
Tabla 1.- Características basales
Resultados ó Outcomes Primario
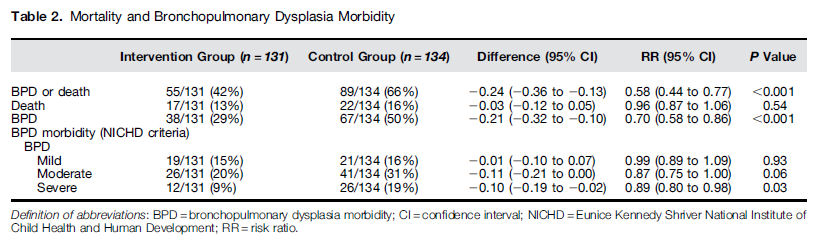
Los RN en el grupo de intervención comparados con los del grupo control tuvieron menor incidencia de DBP ó muerte (55 de 131 [42,0%] versus 89 de 134 [66%] respectivamente; tasa de riesgo 0,58 ; 95 % intervalo de confianza [CI], 0,44-0,77; p < 0,001; número necesario a tratar 4,1 [95% CI, 2,8-7,8]) (Tabla 2).
Tabla 2.- Mortalidad y morbilidad por Displasia Broncopulmonar
Outcome secundario
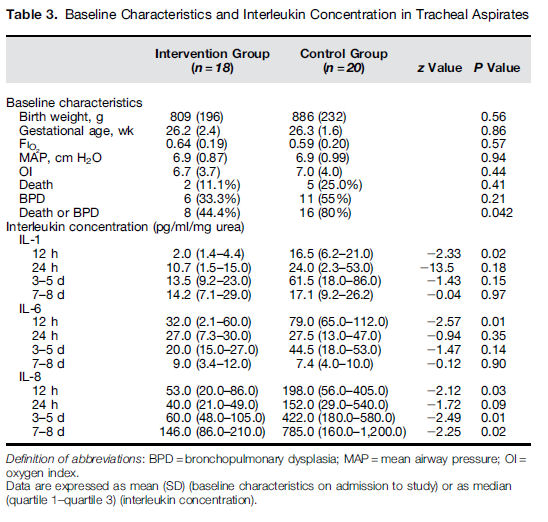
De los 40 RN estudiados para aspirado traqueal de interleucinas, 2 fueron
excluídos debido a muestra incompleta. La intervención fue asociada con valores
de medias significativamente más bajas para IL-1, IL-6 e IL-8 a las 12 horas
(todos p < 0,05) y menor IL-8 en los días 3 - 5 y 7 – 8 en comparación con
el grupo de surfactante solo (Tabla 3).
Tabla 3.- Características basales y concentración de Interleukina en aspirados traqueales
Los grupos fueron comparables en presión sanguínea, glicemia, electrolitos y en crecimiento físico durante el estudio (Figura 2). Los dos grupos fueron comparables en incidencia de hemorragia intraventricular (53 de 131 [40,5%] versus 57 de 134 [42,5%], p=0,8), enterocolitis necrotizante (4 de 131 [3,1%] versus 7 de 134 [5,2%], p=0,56), retinopatía severa del prematuro (7 de 131 [5,2%] vs 9 de 134 [6,8%], p=0,79) y sepsis clínica o bacteriemia (29 de 131 [22%] versus 38 de 134 [28%], p = 0,31).
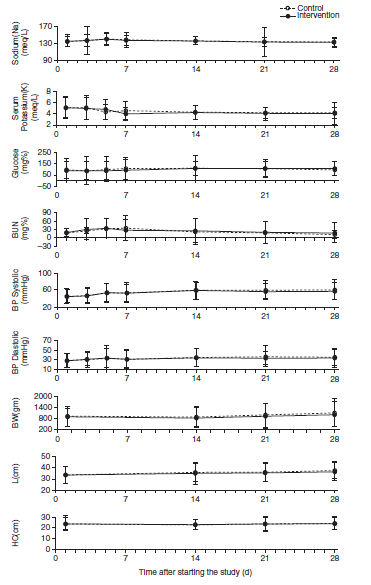
Figura 2.-
Comparación de presión arterial sistólica y diastólica (PA), electrolitos
séricos, glucosa, peso corporal (PC), talla (L) y perímetro cefálico (HC) entre
los grupos control y de intervención durante el estudio. No hubo diferencia
significativa en ninguna de estas variables entre los grupos. BUN = nitrógeno
ureico.
Outcomes exploratorios
Los dos grupos fueron comparables en mortalidad, sin embargo, la intervención
fue asociada con una incidencia significativamente más baja DBP comparada con
surfactante solo (38 de 131 [29,0%] versus 67 de 134 [50,0%], riesgo relativo, 0,70,
95% CI, 0,58-0,86, p < 0,001) (Tabla 2).
La intervención comparada con surfactante solo, fue asociada con un índice de oxigenación significativamente más bajo en los días 1 y 5 y un requerimiento de FiO2 más baja al día 1 y menor presión media de vía aérea durante los primeros 3 días (Figura 3).
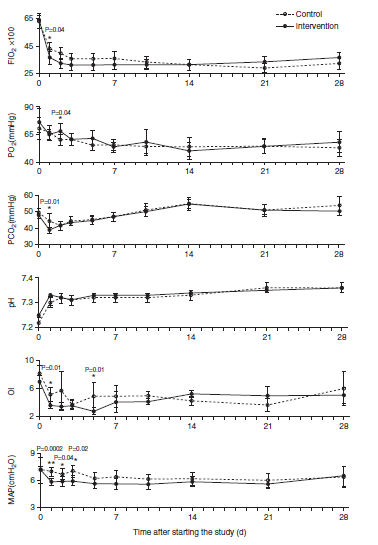
Figura 3.- Cambios en los gases sanguíneos, índice de oxígenación (IO) y presión media de vía aérea (PMVA) durante el estudio. Los valores de promedios, derivados de un modelo lineal generalizado con ecuaciones de estimación generalizadas, se presentan para cada grupo. En comparación con el grupo control, los neonatos del grupo de intervención tenían una FiO2 significativamente menor en el día 1 (Diferencia de promedio [95% intervalo de confianza], -6,1 [-4,06 a -3,12]; P = 0,04), mayor PaO2 en el Día 2 (5,6 [4,26 a 19,4]; p = 0,04), PaCO2 menor en el día 1 (-5,1 [-1,8 a -4,5], p = 0,01), IO menor en el día 1 ( -0,07 [-1,71 a -1,06], p = 0,01) y Día 5 (-2,1 [-2,94 a -1,35], p = 0,01) y PMVA más baja MAPA en Día 1 (-1,08 [-2,61 a -0,46]; P = 0,002), Día 2 (-0,66 [-2,27 a -0,94], p = 0,04) y día 3 (-1,37 [-3,22 a -0,48], p = 0,02). Día 0 en el eje x representa menos de 24 horas, dado que todas las muestras de sangre para gases en sangre se obtuvieron cada mañana antes de la visita de la mañana.
Entre los RN sobrevivientes durante el estudio, los del grupo de intervención tuvieron necesidad de oxígeno terapia asistida significativamente más baja en comparación con aquellos del grupo control en el día 3 (120 de 129 versus 131 de 132, tasa de riesgo y CI 95 %, 0,93 [0,89-0,98], p=0,017), día 7 (110 de 127 versus 119 de 124, 0,91 [0,84-0,97], p=0,021), día 21 (82 de 116 versus 99 de 116, 0,82 [0,73-0,95], p=0,01) y día 28 (73 de 115 vs 88 de 115, 0,83 [0,69-0,98], p=0,044) (Figura 4).
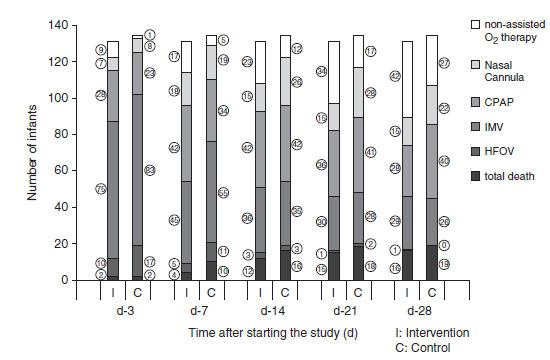
Figura 4.- Número de neonatos que necesitan oxígeno terapia asistida. Oxígenoterapia asistida se definió como requerimiento de cualquiera de los siguientes: cánula nasal, presión positiva continua de vía aérea (CPAP), ventilación mandatoria intermitente (VMI) ó ventilación de alta frecuencia oscilatoria (VAFO). Los sobrevivientes del grupo de intervención requirieron menos oxígenoterapia asistida que los del grupo control en día 3 (p = 0.017), día 7 (P = 0.021), día 21 (P = 0.01), y día 28 (P = 0.044) (ver texto).
Muchos de los RN en el grupo control requirieron cánula nasal ó CPAP incluso con baja FiO2 por un período de tiempo. La intervención fue asociada con una probabilidad significativamente más alta (p = 0.03) de weaning a aire ambiental (Figura 5) y una incidencia significativamente más baja de ductus arterioso persistente significativo (40 de 131 versus 59 de 134, 0,69 [0,49-0,97], p = 0,032). Las duraciones totales de ventilación mecánica invasiva (mediana y rango, 8 [4-62] versus 16 [9-58]d) y oxigenoterapia (32 [4-82] versus 48 [8-102]d) no fueron significativamente diferentes entre ambos grupos.
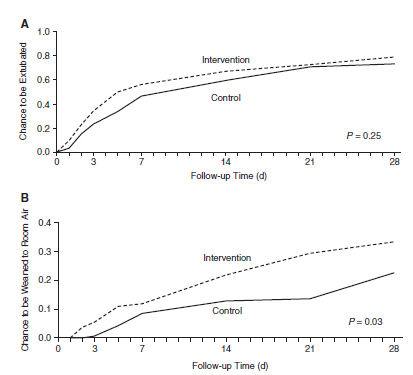
Figura 5. Número y proporción de RN (A) extubados ó (B) meonatos destetados a aire ambiental en el tiempo durante el estudio. Se generaron gráficas de incidencia acumulativa de Kaplan-Meier para mostrar el tiempo al evento para todos los puntos finales. Los neonatos en el grupo de intervención tuvieron una probabilidad significativamente más alta para weaning (destete) a aire ambiental que los niños del grupo de control.
Cuatro RN en el grupo intervención y nueve RN en el grupo control recibieron terapia de dexametasona sistémica. Los RN del grupo de intervención requirieron significativamente menos dosis de surfactante que los RN del grupo control (una dosis: 85 de 131 [64,9%] vs 49 de 134 [36,6%], p < 0,001); dos dosis: 43 de 131 [32,8%] vs 58 de 134 [43,3%], p=0,09; tres dosis: 3 de 131 [2,3%] vs 23 de 134 [17,2%], p < 0,001; cuatro dosis: 0 de 131 [0%] vs 1 de 134 [0,7%]; seis dosis: 0 de 131 [0%] vs 3 de 134 [2,2%]).
Análisis Post Hoc
El análisis post hoc del outcome primario ajustado para esteroides
prenatales, puntaje de Apgar y corioamnionitis también mostró una diferencia
significativa entre el grupo de intervención y el grupo control (Odds
Ratio , 0,37; 95% CI, 0,22-0,54; p < 0,01). Sobre la base de la definición de NICHD, RN en el grupo intervención tuvieron significativamente menor incidencia
de DBP severa que los RN del grupo control (Tabla 2).
Estudio de Seguimiento
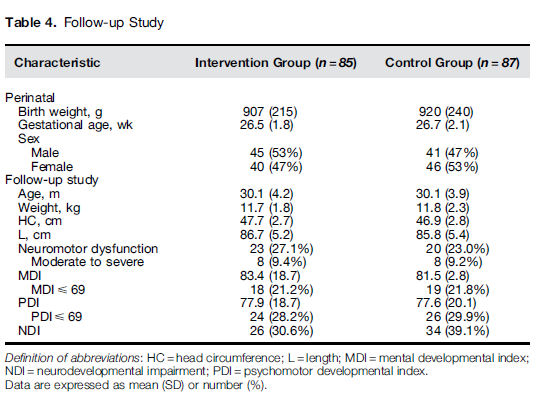
Hasta este momento, 192 (85%) de los 226 RN sobrevivientes están siendo controlados. Las características perinatales y los resultados físicos, neurológicos y cognitivos se muestran en la Tabla 4. Excepto por la más baja incidencia de DBP (25 de 85 [29,4%] versus 39 de 87 [44,8%], p = 0,04) en grupo de intervención al momento del alta, no hubo diferencias significativas entre los grupos en ninguna de las variables en seguimiento. Infecciones respiratorias altas frecuentes ( > 10 veces por año) fue vista menos frecuentemente en el grupo de intervención en comparación al grupo control (15 de 89 [16,9%] versus 24 de 87 [27,6%], p = 0,15), aunque esta diferencia no fue estadísticamente significativa.
Tabla 4.- Estudio de seguimiento
Discusión
Este estudio demostró que en RN de muy bajo peso de nacimiento con EDS
(enfermedad por déficit de surfactante) severa,
la instilación intratraqueal de budesonida / surfactante redujo significativamente la incidencia
de DBP ó muerte comparada con surfactante solo. No se observaron efectos
adversos serios. Budesonida más surfactante fue asociada con mejor status
pulmonar en etapas tempranas del tratamiento y una disminución de la necesidad
de oxigenoterapiaasistida posteriormente. La mejoría de estos parámetros en el grupo intervención
puede ser responsable de la menor incidencia de DBP.
El fundamento para usar surfactante como vehículo está basado en un fenómeno físico, el “efecto Marangoni” 23. Este efecto es básicamente la transferencia de masa en una interface entre dos fluídos debido a una gradiente de tensión superficial. Así, cuando el surfactante es instilado en los pulmones de RN con EDS, se genera un flujo de convección que puede facilitar la entrega de medicamentos, tal como budesonida a la periferia de los pulmones. Varios estudios en animales indicaron que la administración intratraqueal de surfactante y corticoide mejoraron la función pulmonar (24-27). La instilación intratraqueal directa de budesonida sin usar surfactante como vehículo no ha mostrado ser efectiva 28. Un estudio randomizado controlado mostró reducción de muerte ó DBP por budesonida inhalada en RN de extremo bajo peso de nacimiento pero con significancia estadística borderline (29).
Nuestro estudio piloto indicó que más de 80% de la budesonida puede permanecer en los pulmones por hasta 8 horas después de la instilación intratraqueal de survanta/budesonida 9. Además de su uso como vehículo, el surfactante puede también facilitar la solubilidad de la budesonida e incrementar su absorción 30. La budesonida no es metabolizada por las células pulmonares, más bien, es conjugada extensamente con ácidos grasos, causando formación de ésteres de budesonida en el grupo C-21 hidroxilo 31. Este proceso de conjugación es reversible y los conjugados pueden ser hidrolizados dentro de la célula, liberando gradualmente budesonida libre dentro del medio circundante. Esta conjugación reversible puede mejorar la selectividad de la vía aérea y prolongar su acción antiinflamatoria en los pulmones, explicando posiblemente por qué la budesonida fue efectiva por días, incluso aunque sólo una ó dos dosis fueron administradas.
Sobre la base de la farmacocinética 9, los autores estiman que un 5-10% de budesonida puede permanecer aún en los pulmones por una semana. La budesonida que es absorbida a la circulación es rápidamente metabolizada en el hígado a 16- a - hidroxiprednisolona, la cual tiene baja actividad glucocorticoide. La vida media de eliminación plasmática de la budesonida es aproximadamente 4 horas 9. Los resultados del presente estudio también sugieren que un método terapéutico similar puede ser aplicado en casos de pulmón de shock, neumonía, síndrome respiratorio agudo severo ó malignidad. Los efectos adversos sistémicos asociados con esteroides, antibióticos y agentes quimioterápicos pudieran ser significativamente reducidos. Más estudios se necesitan para explorar estas repercusiones clínicas.
El mecanismo responsable de la efectividad de la budesonida probablemente involucra sus efectos antiinflamatorios. La mejoría se observó tempranamente después de la instilación intrataqueal de surfactante / budesonida en contraposición a los 2 - 3 días después de administración sistémica de dexametasona 32. El efecto antiinflamatorio local directo puede haber jugado un rol importante en esta rápida mejoría. La rápida mejoría puede estar también relacionada al volumen más alto de instilación en el grupo de intervención (5 ml/kg) comparado con el grupo control (4 ml/kg); esto puede haber facilitado la entrega de surfactante/budesonida; sin embargo el volumen más alto podría también diluir la concentración de surfactante en la superficie líquido-aire y disminuir la propiedad reductora de tensión superficial del surfactante. Aunque hubo pequeños cambios en la FiO2, PaO2 y PaCO2 durante los primeros días, el grupo intervención necesitó menos oxígeno terapia asistida en los días 3, 7, 21 y 28, sugiriendo un efecto más prolongado en los pulmones. La inflamación pulmonar ocurre tempranamente después de ventilación mecánica y cualquier terapia que sea beneficiosa para prevención de DBP debe ser administrada tan pronto como sea posible.
Los resultados del presente estudio indicaron que la budesonida fue efectiva precozmente en el curso de la terapia, lo cual puede traducirse a efectos a más largo plazo en los pulmones. Se sabe que los corticosteroides causan alteración en el crecimiento. En este estudio los autores no encontraron ninguna alteración inmediata en niveles de glicemia, electrolitos, presión sanguínea y crecimiento con la terapia de budesonida. Otra preocupación importante acerca de la terapia con glucocorticoides es la ocurrencia de efectos adversos a largo plazo. Budesonida ha sido usada en niños con asma por años sin efectos adversos significativosa largo plazo (33-36). Aunque el estudio de seguimiento está todavía en progreso, los datos preliminares en 84% de los sobrevivientes hasta los 2 a 4 años no indican efectos adversos a largo plazo aparentes en crecimiento físico ó en la función neuromotora y cognitiva. En base al estudio previo de seguimiento de los autores 33 y los resultados actuales preliminares y en vista del hecho que la mayoría de los RN (65%) en el grupo intervención recibieron sólo una dosis de budesonida y que no hubo efectos adversos inmediatos, los efectos adversos a largo plazo son probablemente despreciables. Es necesario un completo estudio de seguimiento antes de que este tipo de terapia pueda ser ampliamente recomendada.
Este estudio fue hecho en tres centros terciarios en dos países, lo cual puede originar la pregunta de su aplicación general. Sin embargo, se usaron el criterio diagnóstico y herramientas de evaluación que tienen buena precisión predictiva y han sido evaluadas en diferentes escenarios hospitalarios. Todos los hospitales participantes siguieron un protocolo estándar para el manejo respiratorio. Además, un observador independiente en desconocimiento del tratamiento al que fueron asignados los RN monitoreó el resultado, ésto puede disminuir el sesgo del estudio.
En conclusión, en R Nacidos de muy bajo peso de nacimiento con EMS severa, la administración de surfactante y budesonida intratraqueal comparada con surfactante solo disminuyó significativamente la incidencia de DBP ó muerte. Estudios adicionales de muestras grandes y doble ciego son deseables.
Referencias
Jobe AH, Bancalari E. Bronchopulmonary dysplasia. Am J Respir Crit Care Med 2001;163:1723–1729.
Tyson JE, Wright LL, Oh W, Kennedy KA, Mele L, Ehrenkranz RA, Stoll BJ, Lemons JA, Stevenson DK, Bauer CR, et al.; National Institute of Child Health and Human Development Neonatal Research Network. Vitamin A supplementation for extremely-low-birth-weight infants. N Engl J Med 1999;340:1962–1968.
Schmidt B, Roberts RS, Davis P, Doyle LW, Barrington KJ, Ohlsson A, Solimano A, Tin W; Caffeine for Apnea of Prematurity Trial Group. Caffeine therapy for apnea of prematurity. N Engl J Med 2006;354: 2112–2121.
Committee on Fetus and Newborn. Postnatal corticosteroids to treat or prevent chronic lung disease in preterm infants. Pediatrics 2002;109: 330–338.
Watterberg KL; American Academy of Pediatrics; Committee on Fetus and Newborn. Policy statement—postnatal corticosteroids to prevent or treat bronchopulmonary dysplasia. Pediatrics 2010;126: 800–808.
Shah SS, Ohlsson A, Halliday HL, Shah VS. Inhaled versus systemic corticosteroids for preventing chronic lung disease in ventilated very low birth weight preterm neonates. Cochrane Database Syst Rev 2012;5:CD002058.
Cole CH, Colton T, Shah BL, Abbasi S, MacKinnon BL, Demissie S, Frantz ID III. Early inhaled glucocorticoid therapy to prevent bronchopulmonary dysplasia. N Engl J Med 1999;340:1005–1010.
Shah SS, Ohlsson A, Halliday HL, Shah VS. Inhaled versus systemic corticosteroids for the treatment of chronic lung disease in ventilated very low birth weight preterm infants. Cochrane Database Syst Rev 2012;5:CD002057.
Yeh TF, Lin HC, Chang CH, Wu TS, Su BH, Li TC, Pyati S, Tsai CH. Early intratracheal instillation of budesonide using surfactant as a vehicle to prevent chronic lung disease in preterm infants: a pilot study. Pediatrics 2008;121:e1310–e1318.
Yeh TF, Wu SY, Hsieh WS, Chen CM, Ulllah Z, Gupta S, Cheng JC. Prevention of bronchopulmonary dysplasia in VLBW infants (,1500 gm)—multicenters trial of a new therapeutic regimen. Presented at the Pediatric Academic Societies Annual Meeting. May 4–7, 2013, Washington, DC.
Chen CM, Huang LT, Wang M, Yeh TF. Surfactant supplemented with budesonide for prevention of bronchopulmonary dysplasia— biophysical and chemical stability of surfactant/budesonide mixture. Presented at the 5th Congress of the European Academy of Paediatric Societies. October 17–21, 2014, Barcelona, Spain.
Newman B. Imaging of medical disease of the newborn lung. Radiol Clin North Am 1999;37:1049–1065.
Yeh TF, Raval D, Luken J, Thalji A, Lilien L, Pildes RS. Clinical evaluation of premature infants with patent ductus arteriosus: a scoring system with echocardiogram, acid–base, and blood gas correlations. Crit Care Med 1981;9:655–657.
Shennan AT, Dunn MS, Ohlsson A, Lennox K, Hoskins EM. Abnormal pulmonary outcomes in premature infants: prediction from oxygen requirement in the neonatal period. Pediatrics 1988;82:527–532.
5. Mercier JC, Hummler H, Durrmeyer X, Sanchez-Luna M, Carnielli V, Field D, Greenough A, Van Overmeire B, Jonsson B, Hallman M, et al.; EUNO Study Group. Inhaled nitric oxide for prevention of bronchopulmonary dysplasia in premature babies (EUNO): a randomised controlled trial. Lancet 2010;376:346–354.
Stoll BJ, Hansen NI, Bell EF, Shankaran S, Laptook AR, Walsh MC, Hale EC, Newman NS, Schibler K, Carlo WA, et al.; Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics 2010;126:443–456.
Gadhia MM, Cutter GR, Abman SH, Kinsella JP. Effects of early inhaled nitric oxide therapy and vitamin A supplementation on the risk for bronchopulmonary dysplasia in premature newborns with respiratory failure. J Pediatr 2014;164:744–748.
Wang JY, Yeh TF, Lin YJ, Chen WY, Lin CH. Early postnatal dexamethasone therapy may lessen lung inflammation in premature infants with respiratory distress syndrome on mechanical ventilation. Pediatr Pulmonol 1997;23:193–197.
Costello AM de L, Hamilton PA, Baudin J, Townsend J, Bradford BC, Stewart AL, Reynolds EO. Prediction of neurodevelopmental impairment at four years from brain ultrasound appearance of very preterm infants. Dev Med Child Neurol 1988;30:711–722.
Stoll BJ, Hansen NI, Adams-Chapman I, Fanaroff AA, Hintz SR, Vohr B, Higgins RD; National Institute of Child Health and Human Development Neonatal Research Network. Neurodevelopmental and growth impairment among extremely low-birth-weight infants with neonatal infection. JAMA 2004;292:2357–2365.
Hintze JL. Windows user’s guide I: Power Analysis and Sample Size System (PASS). Kaysville, UT: NCSS; 2008.
Liang KY, Zeger SL. Longitudinal data analysis using generalized linear models. Biometrika 1986;73:13–22.
Adamson AW. Introduction to Marangoni convection. In: Adamson AW, editor. Physical chemistry of surfaces. New York: John Wiley & Sons; 1982. p. 110.
Fajardo C, Levin D, Garcia M, Abrams D, Adamson I. Surfactant versus saline as a vehicle for corticosteroid delivery to the lungs of ventilated rabbits. Pediatr Res 1998;43:542–547.
Chen CM, Fang CL, Chang CH. Surfactant and corticosteroid effects on lung function in a rat model of acute lung injury. Crit Care Med 2001;29:2169–2175.
Yang CF, Lin CH, Chiou SY, Yang YC, Tsao PC, Lee YS, Soong WJ, Jeng MJ. Intratracheal budesonide supplementation in addition to surfactant improves pulmonary outcome in surfactant-depleted newborn piglets. Pediatr Pulmonol 2013;48: 151–159.
Patole SK, Mohan MS, Jog SM, Muller R, Whitehall JS. Prophylactic intratracheal budesonide in preterm neonates at risk for chronic lung disease (CLD)—a pilot study. Presented at the Annual Conference of the Perinatal Society of Australia and New Zealand. March 2–3, 2001, Canberra, Australia. No. 1590.
Lin YJ, Lin HC, Lin CH, Chang SJ, Yeh TF. Double-blind controlled trial of endotracheal instillation of budesonide in preterm infants with RDS: a preliminary report [abstract]. PAS2000:2436. Available from: http://www.abstract2view.com/pasall/view.php?nu=PASOL_2436
Bassler D, Carnielli V, Halliday HL, Hallman M, Jarreau PH, Plavka R,Schwab M, Shinwell ES, Van den Anker J, Poets CF. Early inhaled corticosteroids for the prevention of bronchopulmonary dysplasia in extremely preterm infants: the Neonatal European Study of Inhaled Steroids (NEUROSIS). Presented at the 5th Congress of the European Academy of Paediatric Societies. October 17–21, 2014, Barcelona, Spain.
Wiedmann TS, Bhatia R, Wattenberg LW. Drug solubilization in lung surfactant. J Control Release 2000;65:43–47.
Miller-Larsson A, Mattsson H, Hjertberg E, Dahlb ̈ack M, Tunek A, Brattsand R. Reversible fatty acid conjugation of budesonide: novel mechanism for prolonged retention of topically applied steroid in airway tissue. Drug Metab Dispos 1998;26:623–630.
Yeh TF, Torre JA, Rastogi A, Anyebuno MA, Pildes RS. Early postnatal dexamethasone therapy in premature infants with severe respiratory distress syndrome: a double-blind, controlled study. J Pediatr 1990; 117:273–282.
Kuo HT, Lin HC, Tsai CH, Chouc IC, Yeh TF. A follow-up study of preterm infants given budesonide using surfactant as a vehicle to prevent chronic lung disease in preterm infants. J Pediatr 2010;156: 537–541.
Hvizdos KM, Jarvis B. Budesonide inhalation suspension: a review of its use in infants, children and adults with inflammatory respiratory disorders. Drugs 2000;60:1141–1178.
Agertoft L, Pedersen S. Effects of long-term treatment with an inhaled corticosteroid on growth and pulmonary function in asthmatic children. Respir Med 1994;88:373–381.
Agertoft L, Pedersen S. Effect of
long-term treatment with inhaled budesonide on adult height in children with
asthma. N Engl J Med 2000;343:1064–1069.