Inmunología y Vacunas para Covid - 19
Diciembre - 2020
Consideraciones inmunológicas para las estrategias de la vacuna COVID-19
Mangalakumari Jeyanathan Nature Reviews Immunology 20, 615–632(2020
Traducción Dr Gerardo Flores h Pediatra Neonatólogo
El brote de la enfermedad por
coronavirus 2019 (COVID-19) se informó por primera vez en Wuhan, China,
a fines de 2019 y, al momento de escribir este artículo, desde entonces
se ha extendido a 216 países y territorios1. Ha detenido al
mundo. El síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2),
patógeno viral respiratorio, ha infectado al menos a 20,1 millones
de personas y ha matado a más de 737.000 personas en todo el mundo
1. Aunque el distanciamiento físico y otras estrategias de
mitigación de la transmisión implementadas en la mayoría de los países
durante la pandemia actual han evitado que la mayoría de los ciudadanos
se infecten, estas estrategias los dejarán paradójicamente sin inmunidad
contra el SARS-CoV-2 y, por lo tanto, susceptibles a oleadas adicionales
de infección. Los trabajadores de la salud, las personas mayores y las
personas con problemas de salud subyacentes corren un riesgo
particularmente alto2–4. Es ampliamente aceptado que el mundo
no volverá a su normalidad prepandémica hasta que se disponga de vacunas
seguras y eficaces y se implemente con éxito un programa mundial de
vacunación5. Dado que COVID-19 es nueva para la
humanidad y no se comprende bien la naturaleza de las respuestas
inmunitarias protectoras, no está claro qué estrategias de vacuna serán
más exitosas.
Por lo tanto, es imperativo desarrollar varias plataformas y estrategias
de vacunas en paralelo. De hecho, desde que comenzó el brote, los
investigadores de todo el mundo se han apresurado a desarrollar vacunas
COVID-19, con al menos 166 vacunas candidatas actualmente en desarrollo
preclínico y clínico5 (Figura
1).
Para satisfacer la necesidad urgente de una vacuna, se ha propuesto un nuevo paradigma de desarrollo de vacunas pandémicas que acorta el tiempo de desarrollo de 10 - 15 años a 1 - 2 años6. Sin embargo, sigue sin estar claro , dado que puede constituir una estrategia de vacuna COVID-19 segura e inmunológicamente eficaz, cómo definir puntos finales exitosos en las pruebas de eficacia de la vacuna y qué esperar del esfuerzo mundial de vacunación durante los próximos años. Esta revisión describe los principios inmunológicos rectores para el diseño de estrategias de vacuna COVID-19 y analiza el panorama actual de la vacuna COVID-19 y los desafíos futuros.
1.- Inmunidad natural e inducida por
vacunas
Aunque queda mucho por entender con respecto a la respuesta inmune al SARS-CoV-2, y la inmunidad protectora inducida por la vacuna puede diferir de la inmunidad natural debido a las estrategias de evasión inmune del virus, una mejor comprensión de la respuesta inmune natural será fundamental para desarrollo de estrategias terapéuticas y vacunas eficaces. Es particularmente importante comprender la diferencia en las respuestas inmunes entre los casos asintomáticos, leves y graves y en las etapas temprana y tardía de la infección, y comprender por qué las personas mayores son particularmente susceptibles al COVID-19, mientras que los jóvenes están mejor protegidos. Se estima que entre el 40 y el 75% de las infecciones pueden ser leves o asintomáticas7,8 y los individuos asintomáticos pueden tener una duración significativamente mayor de la diseminación viral que sus contrapartes sintomáticas9. Además, el hecho de que los individuos asintomáticos y levemente enfermos parezcan desarrollar niveles bajos de inmunidad mediada por anticuerpos tiene importantes implicaciones para comprender la inmunidad colectiva.
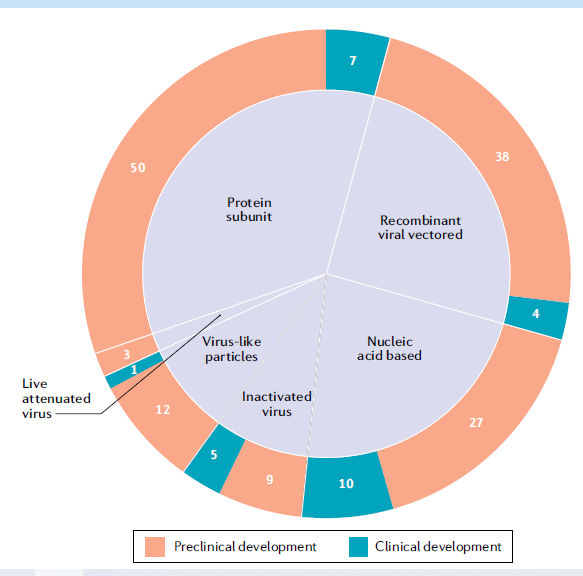
Figura 1.- Panorama mundial de vacuna COVID-19. Se muestran los seis tipos principales de vacuna candidata para la enfermedad por coronavirus 2019 (COVID-19) (virus vivo atenuado, vector viral recombinante, virus inactivado, subunidad proteica, partículas similares a virus y basadas en ácido nucleico), mostrando el número de vacunas candidatas que se encuentran actualmente en desarrollo clínico y preclínico. La plataforma basada en ácidos nucleicos incluye tanto vacunas de ARNm (6 clínicas y 16 preclínicas) como vacunas de ADN plasmídico (4 clínicas y 11 preclínicas). Datos obtenidos de la referencia 5.
El sitio inicial de infección
del SARS-CoV-2 es el tracto respiratorio10,11. Al entrar, el
SARS-CoV-2 interactúa con el receptor de la enzima convertidora de
angiotensina 2 (ACE2) en las células epiteliales bronquiales y
alveolares a través de su dominio de unión al receptor de proteína (RBD)
de espiga o spike (S), que posteriormente es cebado por una proteasa
serina celular específica, la proteasa transmembrana serina 2 (TMPRSS2),
para ganar entrada12,13. El análisis de las transcripciones
que codifican ACE2 y TMPRSS2 mediante secuenciación de ARN unicelular ha
demostrado que estas transcripciones se coexpresan en varios tipos de
células10,11 y, a partir de estudios de autopsia, el SARS-CoV-2
se puede detectar en múltiples órganos, incluidos los pulmones, faringe,
corazón, hígado, cerebro y riñones14.
Respuesta inmune innata
La evidencia emergente sugiere que la respuesta inmune al SARS-CoV-2 es similar en varios aspectos a la respuesta al SARS-CoV o al coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV), los dos coronavirus responsables del brote de SARS 2002-2004 y el Brote de MERS de 2012 que se originaron en China y Arabia Saudita, respectivamente15-17. Al igual que el SARS-CoV y el MERS-CoV, el SARS-CoV-2 suprime la activación del sistema inmune innato, incluidas las células dendríticas18,19, y amortigua las respuestas antivirales de interferón tipo I y tipo III20. Esta capacidad del SARS-CoV-2 para alterar la respuesta inmune innata puede explicar la incubación prolongada o el período presintomático de 2 a 12 días para COVID-19 en relación con el período de incubación de 1 a 4 días para la influenza16. Por lo tanto, la replicación incontrolada del SARS-CoV-2 en la fase temprana de la infección resultante de la supresión inmune innata probablemente apuntala las consiguientes respuestas inflamatorias desreguladas16,21, particularmente en casos severos de COVID-19. Estos casos se caracterizan por un marcado aumento de monocitos y neutrófilos inflamatorios en la sangre20,22,23 y macrófagos derivados de monocitos CD14 + CD16 + en las vías respiratorias20,24, y un aumento de los niveles sistémicos de citocinas y quimiocinas inflamatorias20,22,23.
La falta de control temprano de la infección por SARS-CoV-2 en el tracto respiratorio probablemente resulte en una alta carga viral y respuestas inflamatorias e inmunopatología desreguladas y potencialmente letales, incluyendo el síndrome de dificultad respiratoria aguda. Por esta razón, las personas mayores y las personas con comorbilidades pueden ser particularmente propensas al COVID-19 debido a la inmunosenescencia y su propensión a generar respuestas inflamatorias exageradas25-27.
Además de la consideración de la inmunidad adaptativa inducida por la vacuna que se analiza más adelante, la inclusión del concepto recientemente surgido de inmunidad entrenada (Cuadro 1) en el diseño de la vacuna COVID-19 podría reforzar aún más la protección, particularmente en las primeras fases de la infección.
Cuadro 1.- Inmunidad entrenada
como potencial estrategia de vacuna COVID-19
La memoria inmune innata (también
conocida como inmunidad entrenada) es un componente recientemente
reconocido de la memoria inmunológica que tiene implicancias para las
estrategias de vacuna83,84,168,169. Varias vacunas humanas
vivas atenuadas inducen una inmunidad entrenada que puede mediar
respuestas protectoras inespecíficas a infecciones heterólogas además de
la memoria inmunitaria adaptativa específica de patógenos168-170.
La vacuna humana mejor estudiada que induce inmunidad entrenada es la
vacuna contra la tuberculosis del bacilo de Calmette-Guérin (BCG )171.
La vacunación con BCG confiere a los monocitos circulantes
características de inmunidad entrenada mediante el recableado
epigenético y metabólico de los progenitores mieloides en la médula ósea169,172,173.
Estos monocitos entrenados mejoran la protección contra infecciones
heterólogas, incluida la infección viral respiratoria174-176.
Por lo tanto, BCG puede ofrecer un nivel de protección contra la
enfermedad por coronavirus 2019 (COVID-19), que podría estar respaldado
por la correlación inversa observada entre la vacunación universal con
BCG y las muertes por COVID-19177. Se están llevando a cabo varios
ensayos clínicos para evaluar los efectos de la vacuna BCG o contra el
sarampión sobre el COVID-19 178.
Una vacuna COVID-19 que pueda inducir la inmunidad entrenada podría
mejorar el control viral temprano superando la supresión inmune innata
impuesta por el virus y facilitando la activación inmune adaptativa. El
momento temprano de acción de la inmunidad entrenada es de importancia
ya que la sobreproducción de citocinas por los macrófagos en las etapas
posteriores de COVID-19 puede contribuir a la inmunopatología. Aunque
queda por entender cómo aprovechar mejor la inmunidad entrenada para las
estrategias de la vacuna COVID-19, la evidencia reciente sugiere que las
rutas de exposición microbiana o vacunación determinan la distribución
tisular de la inmunidad entrenada83,84,169. Dado que la inmunidad de la
mucosa respiratoria es clave para la eliminación temprana del síndrome
respiratorio agudo severo coronavirus 2 (SARS-C oV-2), inducir la
inmunidad entrenada en macrófagos alveolares y otras células innatas83,179-181
mediante la vacunación de la mucosa respiratoria podría ser una
estrategia eficaz. De hecho, una vacuna vectorizada por adenovirus de
serotipo 5 humano administrada a la mucosa respiratoria induce
macrófagos alveolares de memoria capaces de ejercitar la inmunidad
contra infecciones heterólogas85. Sin embargo, no está claro
si los macrófagos de la memoria pulmonar pueden ser reemplazados por
monocitos inflamatorios en respuesta al SARS-CoV-2.
Respuestas de anticuerpos.
Anticuerpos IgM e IgG contra el SARSCoV-2 son detectables entre 1 y 2 semanas después del inicio de los síntomas en la mayoría de las personas infectadas28. Aunque aún no se conoce la relación entre los anticuerpos neutralizantes y las células T específicas de antígeno y la gravedad de la enfermedad y los resultados clínicos, se han observado altos niveles de anticuerpos neutralizantes en individuos convalecientes29, que se correlacionan con las respuestas de las células T, en particular las de las células T CD4 +30, y parecen ofrecer algunos beneficios en estudios de tratamiento con plasma de convalecencia31.
Estudios recientes indican que la magnitud de las respuestas de anticuerpos neutralizantes se correlaciona positivamente con la gravedad de la enfermedad32. Así, mientras que las respuestas de anticuerpos disminuyen semanas después de la infección en la mayoría de las personas infectadas con SARS-CoV-2 32, que es una característica de las respuestas de anticuerpos a otros coronavirus del 'resfriado común '17, la magnitud de la respuesta de anticuerpos neutralizantes en individuos asintomáticos no solo es más pequeño sino que también disminuye más rápidamente que en individuos sintomáticos9.
El objetivo principal de los anticuerpos neutralizantes frente a los coronavirus es la proteína S, que está compuesta por los dominios S1 y S2. S1 es la membrana distal y contiene el RBD que se une al receptor celular ACE2. S2 es la membrana proximal y tiene un rol en la fusión de la membrana33. Las proteínas S de SARS-CoV y SARS-CoV-2 son idénticas en un 88% y ambas se unen a ACE2 con alta afinidad33. Ciertos anticuerpos monoclonales y policlonales producidos contra la proteína S del SARS-CoV pueden neutralizar de forma cruzada el SARS-CoV-2 33,34. Los anticuerpos que se unen al RBD de S1 bloquean su interacción con ACE2, mientras que los que se unen a otras regiones de S1 y S2 pueden inhibir el cambio conformacional de la proteína S y bloquear la fusión de la membrana, respectivamente35-37.
Durante las respuestas inmunes
naturales al SARS-CoV-2, también se generan títulos elevados de
anticuerpos contra la nucleoproteína (N), la proteína viral más
abundante38–40. Aunque es poco probable que los anticuerpos
contra N neutralicen el virus, se ha reportado que brindan protección
contra el virus de la hepatitis de ratón, un coronavirus de los ratones.
Es destacable, que estos anticuerpos eran IgG2a, lo que indica que
pueden ejercer protección a través de funciones efectoras mediadas por
Fc en lugar de la neutralización directa del virus41,42. De forma algo
inusual, varios estudios han informado que las respuestas de IgA a la
proteína S alcanzan un peak antes que las respuestas de IgM y son más
pronunciadas, lo que hace que la IgA sea un target u objetivo potencialmente
atractivo para los estudios diagnósticos basados en anticuerpos43,44.
La base mecanicista de esta inducción temprana de IgA específica de S
aún no está clara.
Todavía no se entiende la durabilidad de las respuestas de anticuerpos al SARS-CoV-2. Sin embargo, estudios longitudinales previos de pacientes
con infección por SARS-CoV reportaron una disminución sustancial de los
títulos de anticuerpos neutralizantes entre 1 y 2 años después de la
infección45,46. Esto es consistente con los estudios clásicos que
muestran una disminución relativamente rápida de los anticuerpos contra
el coronavirus estacional 229E 47. Actualmente no existen correlatos
inmunitarios de protección para el SARS-CoV-2 u otros coroanvirus
humanos. Por tanto, no está claro qué
título de anticuerpos neutralizantes es suficiente para conferir
protección contra la infección. El establecimiento de tales
correlaciones será esencial para guiar el desarrollo de vacunas COVID-19
efectivas.
Inmunidad mediada por linfocitos T.
Mientras que las actuales vacunas antivirales humanas exitosas, como las vacunas contra la influenza y el sarampión, dependen en gran medida de la inducción de respuestas de anticuerpos, la evidencia emergente sugiere el requerimiento de inmunidad tanto mediada por anticuerpos como mediada por células T para una protección eficaz contra el SARS-CoV-2 17, 27.
Es bien
sabido que la ayuda de las células T CD4 + es importante para las
respuestas óptimas de anticuerpos y para la activación de las células T
CD8 + en la defensa del huésped48. Además, si la protección mediada por
anticuerpos neutralizantes es incompleta, las células T CD8 +
citotóxicas son cruciales para la eliminación viral49. Un estudio
encontró que entre las personas que se habían recuperado de COVID-19, el
100% tenía células T CD4 + específicas de la proteína S en la
circulación y el 70% tenía células T CD8 + específicas de la proteína S
en la circulación30, y los estudios preclínicos muestran un
rol
protector de las células T en la defensa del huésped contra el SARS-CoV50.
El período de incubación de 2 a 12 días o período presintomático de la
infección por SARS-CoV-2 se asocia no solo con la supresión inmune
innata mediada por virus, sino también con la activación retardada de
las células T, en particular las células T CD8 +18,19, como es el caso
del SARS y MERS . Las personas que se han recuperado de COVID-19 parecen
tener altos niveles de anticuerpos neutralizantes y de células T y, en
comparación con los casos graves, los casos más leves de COVID-19 tienen
una mayor cantidad de células T CD8 + de memoria en el tracto
respiratorio24,29,30 . La evidencia sugiere que la inducción de tales
células T de memoria residentes en tejido pulmonar (células TRM)
dependerá de la vía de vacunación. La vacunación de la mucosa
respiratoria induce fuertes respuestas de las células TRM pulmonares,
mientras que la vacunación parenteral no lo consigue51–53.
Experimentalmente, las células TRM de las vías respiratorias provocadas
por la vacunación de la mucosa respiratoria ofrecieron una protección
sólida contra infección por SARS- CoV 54.
El fenotipo de células T colaboradoras (células TH) de las células T inducidas por la vacuna también es relevante para la protección que median. Los casos menos graves de SARS se asociaron con la inducción acelerada de una respuesta de las células TH155, mientras que las respuestas de las células TH2 se han asociado con un facilitamiento de la enfermedad pulmonar después de la infección en huéspedes que han sido vacunados por vía parenteral con vacunas virales del SRAS-CoV inactivado56,57. Por lo tanto, las células TRM inducidas por la vacuna COVID-19 deberían tener un fenotipo similar a las células TH1.
Estas líneas de evidencia, junto con los datos que sugieren que la inmunidad mediada por células T generalmente es un correlato más confiable de la protección de la vacuna que los títulos de anticuerpos en personas mayores26, apoyan fuertemente la inclusión de respuestas de células T en el diseño de la vacuna COVID-1917,27
Inmunidad preexistente de reacción cruzada.
La evidencia emergente indica que las células T CD4 + en el 35% de las personas sanas no expuestas al SARS-CoV-2 reconocen la proteína S del SARS-CoV-2 y que las células T CD4 + en el 40-60% de las personas no expuestas son reactivas al SARS-CoV- 2 proteínas distintas de la proteína S30,58. Esto indica que existe una reactividad cruzada entre las células T CD4 + específicas para el SARS-CoV-2 y las células T CD4 + específicas para los coronavirus del resfriado común humano, el SARS-CoV y los betacoronavirus animales17,59–61. Hay cuatro coronavirus humanos, 229E, NL63, OC43 y HKU1, que representan aproximadamente el 15% de los resfriados comunes en humanos17. Los adultos pueden infectarse con uno de estos en promedio cada 2-3 años, de modo que podría haber un grado de inmunidad cruzada preexistente a los antígenos del SARS-CoV-2 en estas personas, lo que ofrece una posible explicación de la diferente susceptibilidad a infección por SARS-CoV-2. Además de comprender la relación entre dicha inmunidad preexistente a los coronavirus humanos y la defensa del huésped contra el SARS-CoV-2, también será importante considerar la contribución de las respuestas inmunitarias de reactividad cruzada potenciadas por la vacuna COVID-19 a la inmunidad protectora inducida por vacuna.
Es importante destacar que,
mientras que las células T CD4 + de pacientes con COVID-19 reconocen
igualmente las subunidades S1 y S2 del SARS-CoV-2, las células T CD4 +
con reactividad cruzada de individuos no expuestos reconocen la
subunidad S258. Las células T CD4 + de pacientes con
reactividad cruzada a COVID-19 reaccionan fuertemente con las
subunidades S2 de los coronavirus humanos OC43 y 229E. Más del 90%
de los adultos sanos evaluados también tienen anticuerpos IgG
específicos para los cuatro coronavirus del resfriado común humano17.
Sin embargo, de manera similar a las respuestas de anticuerpos al SARS-CoV
y al SARS-CoV-2, las respuestas de anticuerpos a los coronavirus humanos
disminuyen rápidamente meses después de la infección. Por lo tanto, el
control de la reinfección con coronavirus humanos parece ser
principalmente independiente de anticuerpos pero dependiente de células
T17. Dado que las células T con reactividad cruzada con
coronavirus pueden ser específicas para proteínas virales estructurales
y no estructurales58,61, el grado de respuestas de células T
con reactividad cruzada potenciadas por la vacuna inducidas por la
mayoría de las subunidades proteicas y las vacunas COVID-19 con vector
viral recombinante, que actualmente se basan únicamente en la proteína
S, serán diferentes de las potenciadas (boosted) por vacunas COVID-19
multivalentes, tales como las basadas en el virus SARS-CoV-2 inactivado.
Una excepción podría ser el uso de vacunas vivas atenuadas contra el
SARS-CoV-2, dado que la inmunidad de reacción cruzada preexistente puede
limitar la potencia de tales vacunas.
Por último, cabe señalar que la presencia significativa de inmunidad de
reacción cruzada en algunas personas requiere la consideración de
estratificar a los participantes de ensayos clínicos que reciben vacunas
COVID-19 candidatas según su estado de inmunidad preexistente al
coronavirus
Facilitamiento de la enfermedad dependiente de anticuerpo
Una barrera potencial para el desarrollo de vacunas COVID-19 seguras y eficaces (Cuadro 2) es el riesgo de que títulos insuficientes de anticuerpos neutralizantes puedan desencadenar un facilitamiento de la enfermedad dependiente de anticuerpos (ADE). El ADE se asocia más clásicamente con el virus del dengue, por lo que las concentraciones de anticuerpos de reacción cruzada pero subneutralizantes de un serotipo de virus potencian la infección con otro serotipo en las células portadoras del receptor Fcγ (FcγR), incluidos los macrófagos62. Una propiedad común entre los virus que causan ADE es la capacidad de replicarse en los macrófagos y / o hacer que respondan de manera anormal.
Aunque los macrófagos no parecen
ser un target u objetivo importante de la infección por SARS-CoV-2, y la
expresión de ACE2 en diferentes poblaciones de monocitos y macrófagos es
muy variable, los datos previos sobre el SARS-CoV sugieren que los FcγR
pueden facilitar la absorción del virus por los macrófagos y células B21,63.
Los perfiles de citocinas de pacientes infectados con SARS-CoV-2 se
parecen a los del síndrome de activación de macrófagos y se caracterizan
por niveles elevados de citocinas y quimiocinas inflamatorias21,64-66.
Además, se informa que los pacientes con COVID-19 sintomático producen
anticuerpos IgG con niveles de fucosilación reducidos, lo que a su vez
promueve su interacción con la activación de FcγRIIIa67.
La evidencia de ADE en el contexto de la infección por SARS-CoV es
circunstancial. Se han informado correlaciones entre los títulos de
anticuerpos y la gravedad de la infección, pero no está claro si los
títulos altos de anticuerpos contribuyen a la enfermedad o si las
infecciones graves provocan títulos de anticuerpos más altos68.
Además, los macrófagos tratados in vitro con suero de pacientes con SARS
tenían perfiles de citocinas inflamatorias exageradas69,70.
Se ha informado de ADE en algunos modelos animales preclínicos vacunados
con vacunas experimentales contra el SARS-CoV. Los hurones vacunados con
una vacuna modificada del virus de vacuna Ankara (MVA) que expresa la
proteína S de longitud completa presentaron un aumento de la infección y
hepatitis después de la exposición71,72. Se reportó que los
anticuerpos contra la proteína S inducen lesión pulmonar aguda en
macacos infectados experimentalmente sobre la base del examen
histológico. 69
Por el contrario, los hámsteres vacunados con proteína S de SARS_CoV RAG-CoV de longitud completa recombinante de longitud completa estaban protegidos contra la infección a pesar de la capacidad de los anticuerpos para mediar la entrada del SRAS-CoV en las células B a través de FcγRII 73. No está claro si el ADE ocurre en el contexto de la infección por SARS-CoV-2, pero merece una mayor investigación, centrándose directamente en si los anticuerpos aumentan la gravedad de la enfermedad y, de ser así, caracterizando las propiedades específicas de estos anticuerpos. Lo que parece claro es que altos niveles de anticuerpos neutralizantes pueden mediar la protección.
Definir los títulos de anticuerpos neutralizantes que son protectores, garantizar que las vacunas COVID-19 puedan alcanzar estos títulos y evitar la disminución de los anticuerpos a niveles subneutralizantes mediante un refuerzo frecuente será importante para minimizar la posibilidad de ADE. Las vacunas COVID-19 diseñadas racionalmente que omiten los epítopos inductores de ADE, no neutralizantes o débilmente neutralizantes en favor de aquellos que se sabe que median las respuestas protectoras también pueden minimizar la probabilidad de facilitamiento (enhacement) de la enfermedad. Finalmente, también hay evidencia de modelos de ratón de infección por el virus del dengue de que las células T antivirales ayudan a amortiguar el ADE de la enfermedad74. Por lo tanto, una estrategia de vacuna diseñada para inducir tanto anticuerpos neutralizantes como una sólida inmunidad mediada por células T puede ayudar a mitigar el riesgo de ADE
Cuadro 2.- Consideraciones de seguridad para vacunas COVID-19
Dado que la mayoría de las personas infectadas con síndrome respiratorio agudo severo el coronavirus 2 (SARS-C oV-2) son asintomáticas o desarrollan solo síntomas leves y las vacunas contra la enfermedad del coronavirus 2019 (COVID-19) se están desarrollando hacia el objetivo final de la inmunización masiva mundial, la seguridad de las vacunas es de suma importancia. Cualquier indicio de falta de consideraciones de seguridad también podría alimentar el movimiento contra la vacunación y la vacilación a la vacuna, lo que pondría en peligro el efecto deseado de lograr la inmunidad colectiva. En este sentido, la mayoría de los ensayos clínicos actuales de la vacuna COVID-19 se realizaron inicialmente en adultos sanos de 55 años o menos, y sólo algunos ensayos en etapas posteriores incluyeron personas mayores98,99,115,146-148. Las poblaciones de ancianos altamente susceptibles y aquellas con enfermedades subyacentes necesitan en particular vacunas altamente seguras y eficaces. En gran parte, no está claro si alguna de las vacunas COVID-19 probadas inicialmente será segura tanto para niños pequeños como para personas mayores, tanto a corto como a largo plazo. Es probable que se requiera una estrategia de vacuna diferente con perfiles de seguridad y eficacia comprobados para la protección de las personas mayores
La seguridad de una vacuna generalmente está determinada por la naturaleza de la plataforma de la vacuna, la elección del adyuvante, el modo y la vía de administración de la vacuna, la edad de los vacunados y el status de inmunidad preexistente a la vacuna 78. Por ejemplo, la replicación de vacunas con virus vivos atenuados o con vectores virales puede no ser segura para una vía de vacunación de la mucosa respiratoria. Tampoco lo son ciertos adyuvantes inmunes como el aluminio y las proteínas derivadas de bacterias. Cuando se requiere una estrategia de vacunación de refuerzo, los eventos adversos son generalmente más frecuentes e intensos después de la vacuna de refuerzo115. Las estrategias de vacunación para COVID-19, como para algunas otras infecciones virales respiratorias, requieren consideraciones de seguridad adicionales relacionadas con la posibilidad de un facilitamiento de la enfermedad dependiente de anticuerpos y el rol de la sobreproducción de citocinas proinflamatorias en la inmunopatología pulmonar. Esto último se refiere particularmente a la aplicación de estrategias de vacunación de la mucosa respiratoria.
Diseño de la vacuna
El diseño de la vacuna se
refiere a la selección de antígenos, plataformas de vacunación y rutas y
regímenes de vacunación. La elección de la plataforma de la vacuna
determina la fuerza inmunogénica relativa de los antígenos virales
derivados de la vacuna, si se requiere un adyuvante inmune y la
naturaleza de la inmunidad protectora. Estos atributos también
determinan la idoneidad de una vacuna para una ruta particular de
vacunación, y si se requiere un régimen de vacunación de refuerzo para
aumentar la inmunidad protectora mediada por la vacuna y su durabilidad.
Además, la selección de vacunas virales vivas atenuadas o una vía de
vacunación de la mucosa respiratoria requerirá pruebas de seguridad más
estrictas (Cuadro 2).
Selección de antígenos de SARS- CoV-2
Las proteínas estructurales presentes en el virión infeccioso incluyen proteína S, proteína N, proteína de matriz (M) y proteína de envoltura (E). La proteína N recubre el genoma de ARN de cadena positiva grande, que está encerrado en una envoltura lipídica derivada de la membrana de la célula huésped, en la que se insertan las otras tres proteínas (S, M y E). En el caso del SARS-CoV, se ha demostrado que solo los anticuerpos dirigidos a la proteína S pueden neutralizar el virus y prevenir la infección75. Como resultado, todas las vacunas contra el SARS-CoV-2 en desarrollo incluyen al menos una porción de la proteína S. Estos pueden estar restringidos solo al dominio S1 o al RBD.
Se generan anticuerpos no neutralizantes tanto para la proteína S como para las otras proteínas expuestas (E y M). Dado que se sospecha un papel de estos anticuerpos no neutralizantes, así como de los anticuerpos débilmente neutralizantes, en el ADE de la enfermedad, la inclusión de otras proteínas estructurales (N) y / o no estructurales como antígenos de la vacuna puede ayudar a crear una respuesta más balanceada involucrando ambas, inmunidad humoral y mediada por células T.
Estas podrían ser proteínas altamente expresadas como la proteína N o proteínas funcionales altamente conservadas que tienen un papel crucial en el ciclo de vida viral. Por ejemplo, la inclusión de enzimas virales como la ARN polimerasa dependiente de ARN en el diseño de una vacuna puede asegurar que se dirija a todas las cepas variantes emergentes, ya que estas proteínas están altamente conservadas59,76,77, incluso a través de otros coronavirus derivados de murciélagos que podrían surgir. como una amenaza para los humanos en el futuro.
Plataformas de vacuna
En general, las plataformas de vacunas se dividen en seis categorías: virus vivos atenuados, vacunas recombinantes con vectores virales que se diseñan mediante bioingeniería para expresar antígenos patógenos diana in vivo, virus inactivados o muertos, vacunas de subunidades proteicas, partículas similares a virus (VLP) y vacunas basadas en ácido nucleico - ADN o ARNm. En términos generales, las vacunas requieren dos componentes: antígenos del patógeno target o diana que son proporcionados o generados por el receptor de la vacuna; y una señal de infección (tal como un patrón molecular asociado al patógeno o un patrón molecular asociado a daño) que alerta y activa el sistema inmune del huésped. Las vacunas vivas atenuadas pueden proporcionar de forma natural ambos componentes, mientras que las plataformas de vacunas no virales pueden proporcionar los antígenos, pero a menudo requieren la provisión artificial de señales para alertar al sistema inmunológico conocidas como adyuvantes.
Por lo general, estas plataformas de vacunas no virales requieren múltiples vacunas para inducir la inmunidad protectora, mientras que las vacunas basadas en virus vivos tienen la capacidad de proporcionar inmunidad de "una sola inyección". De manera similar a las plataformas no virales, las vacunas de virus muertos a veces requieren la inclusión de un adyuvante y la administración repetida para una eficacia total78. Existen pros y contras inmunológicos para cada una de estas tecnologías, como se analiza más adelante (Tabla 1).
Tabla 1.- Propiedades inmunológicas de las plataformas de las principales vacunas candidatas para COVID-19
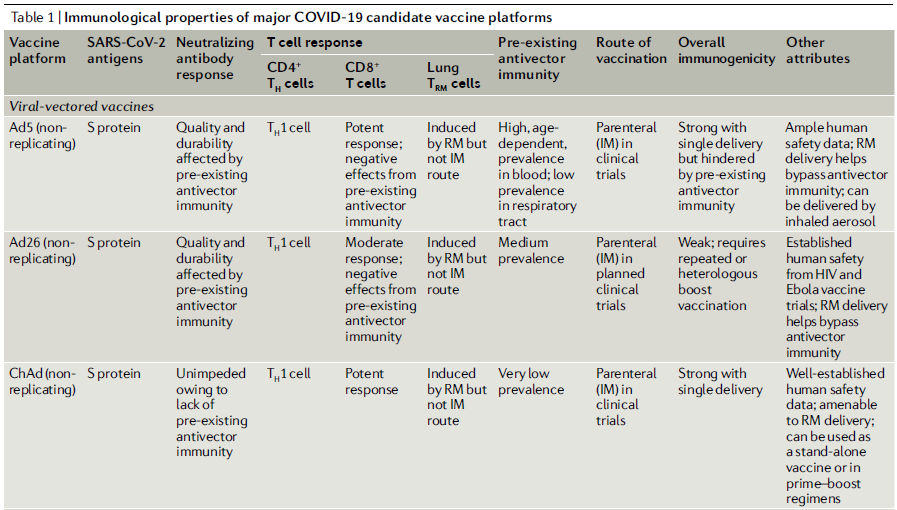
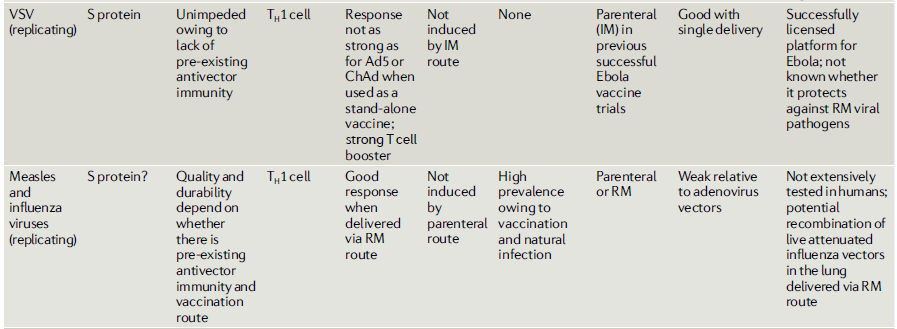
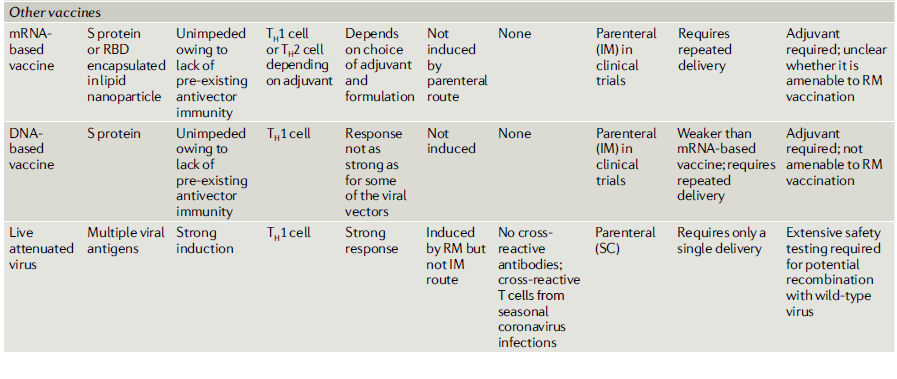
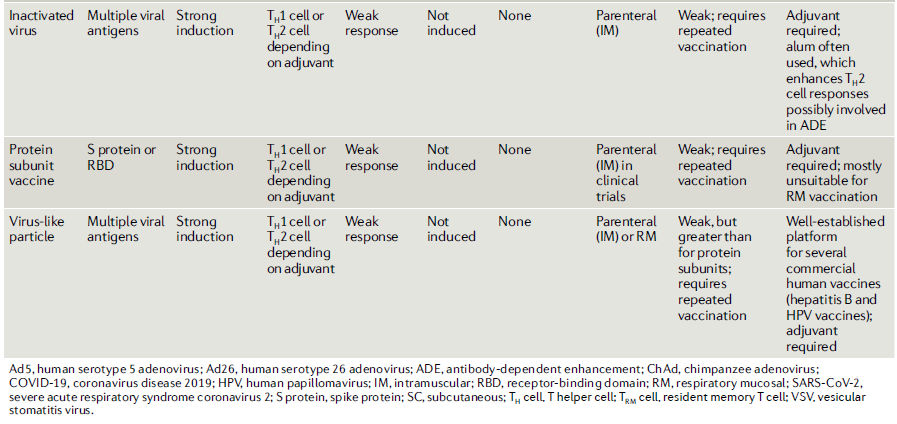
Vías y regímenes de vacunación
Además de la cuidadosa selección de los antígenos y la plataforma de la vacuna, la ruta de vacunación es una consideración integral de las estrategias de vacuna52,79. Esto es particularmente importante para los patógenos de las mucosas como el SARS-CoV-2 y aquellos patógenos contra los cuales la protección óptima requiere no solo anticuerpos neutralizantes sino también inmunidad celular innata y adaptativa17,80. La mejor ventana de oportunidad para el control y la eliminación del SARS-CoV-2 es el período asintomático o presintomático de COVID-19 (2 a 12 días), que probablemente requiera que todos los elementos de protección inmunitaria estén presentes dentro de la mucosa respiratoria antes de la entrada viral16,17,27. La vía de vacunación tiene un papel crucial para determinar ésto 52,81.
Los anticuerpos IgG protectores
inducidos por la vacunación parenteral aparecen fácilmente en la mucosa
respiratoria, siendo éste el mecanismo principal por el cual la
inyección intramuscular de la vacuna contra el sarampión o la influenza
ofrece protección en humanos. Sin embargo, esta vía de vacunación es
incapaz de inducir eficazmente anticuerpos IgA mucosos o células TRM en
los pulmones52,81.
En comparación, la vía de vacunación de la mucosa respiratoria es
experta en inducir anticuerpos y células TRM en la mucosa respiratoria,
así como tambien en la inmunidad entrenada mediada por macrófagos52,54,80-85
(Cuadro 1). Las vacunas de virus
inactivados, subunidades proteicas y ácidos
nucleicos no pueden administrarse por la vía de la mucosa
respiratoria debido a que requieren adyuvantes inmunes potencialmente
peligrosos y administración repetida (Tabla 1). Por el contrario, las
vacunas recombinantes con vector viral, en particular las que utilizan
adenovirus de serotipo 5 humano (Ad5) o adenovirus derivado de chimpancé
(ChAd), son seguras y muy eficaces para la vacunación de la mucosa
respiratoria79.
A menudo, las vacunas débilmente inmunogénicas basadas en virus inactivados, subunidades de proteínas, ácidos nucleicos o vectores virales tales como Ad26 requieren un régimen de vacunación homólogo repetido para ser eficaces. De hecho, la mayoría de las vacunas humanas actuales requieren dosis repetidas. Dado que aún no se sabe qué estrategia de vacuna COVID-19 se utilizará o cuánto tiempo puede durar la protección inducida por la vacuna en humanos, sigue siendo posible que se requiera un régimen de vacunación de refuerzo homólogo o heterólogo para mantener la protección, incluso con robustas plataformas independientes como ChAd. Se puede usar la misma ruta o una diferente para la administración repetida de la vacuna.
Principales vacunas candidatas para COVID-19
Al 31 de julio de 2020, había
27 vacunas candidatas para COVID-19 en evaluación clínica y 139 vacunas
en desarrollo preclínico5 (Figura
1). De las 27 vacunas que se
someten a evaluación clínica (Tabla
2), las tres principales
candidatas son vacunas con vector viral y basadas en ARNm que entraron
en ensayos clínicos en China, el Reino Unido y los EE. UU. a
mediados de marzo de 2020. Ensayos clínicos para las 24 candidatas
restantes actualmente están reclutando voluntarios y un par de otros
candidatas también están a punto de participar en ensayos clínicos (Tabla
2). La evaluación preclínica
de las vacunas candidatas requiere el uso de modelos animales relevantes
de COVID-19 (Cuadro 3). Convencionalmente, la seguridad, inmunogenicidad
y eficacia protectora de las vacunas experimentales se evalúan
rigurosamente y se establecen en modelos animales antes de comenzar los
ensayos clínicos. Sin embargo, en el caso del desarrollo de una vacuna
pandémica, las etapas preclínicas y clínicas del desarrollo de la vacuna
se comprimen y avanzan en paralelo
Vacuna de virus vivos atenuado
Históricamente, varias vacunas humanas exitosas, tales como la vacuna contra el sarampión y la vacuna del bacilo Calmette-Guérin (BCG) para la tuberculosis (TB), se han basado en cepas atenuadas del patógeno real 86, con pérdida o mutación de genes de virulencia mediante pases in vitro. Ahora es posible diseñar racionalmente cepas de virus atenuados mutando o eliminando genes de virulencia. Estos mutantes por deleción a menudo se pueden replicar en un grado limitado en las células huésped, pero pierden la capacidad de causar enfermedades in vivo. Los coronavirus tienen varios genes que no son necesarios para la replicación y que pueden eliminarse, lo que causa una atenuación in vivo.
La deleción de varias proteínas no
estructurales, así como de la proteína estructural E, se ha utilizado
como estrategia para diseñar cepas vaccinales de varios coronavirus
zoonóticos y veterinarios87–89. La deleción de la proteína E
causa atenuación y generación de una cepa vacunal eficaz87,88,
pero se ha reportado reversión del fenotipo atenuado90. Por
tanto, la eliminación de factores de virulencia puede proporcionar un
mecanismo de atenuación preferido.
Por ejemplo, la deleción del gen 2′-O-metilasa del genoma del SARS-CoV
elimina la capacidad del virus para ocultar su ARN de las proteínas de
la célula huésped MDA5 (también conocida como IFIH1) e IFIT1, induciendo
así una respuesta antiviral robusta in vivo91. Otro enfoque
para la atenuación viral se conoce como desoptimización de codones,
mediante el cual la secuencia de ácido nucleico se modifica para usar
codones subóptimos para codificar la secuencia de aminoácidos de tipo
salvaje, lo que ralentiza considerablemente la traducción de la proteína
viral durante la infección. Este enfoque puede producir un virus que
está altamente atenuado in vivo pero aún capaz de replicarse in vitro si
se selecciona la proteína viral correcta para la desoptimización.92,93
Sin embargo, la generación de una cepa atenuada de un patógeno para su uso como vacuna requiere la demostración de su incapacidad para revertir genéticamente para convertirse en patógeno (Cuadro 1; Cuadro 2). Esto es particularmente desafiante en el caso de los coronavirus, ya que se sabe que se recombinan en la naturaleza94, y una cepa de vacuna atenuada podría, en teoría, recombinarse con coronavirus salvajes para recrear una cepa patógena. Hasta ahora, solo hay tres vacunas atenuadas contra el SARS-CoV-2 generadas por desoptimización de codones en desarrollo preclínico, por la Universidad Mehmet Ali Aydinlar en Turquía, Codagenix and Serum Institute of India e Indian Immunologicals Ltd y Griffith University5
Tabla 2.- COVID-19 vacunas candidatas en o entrando a estudios clínicos
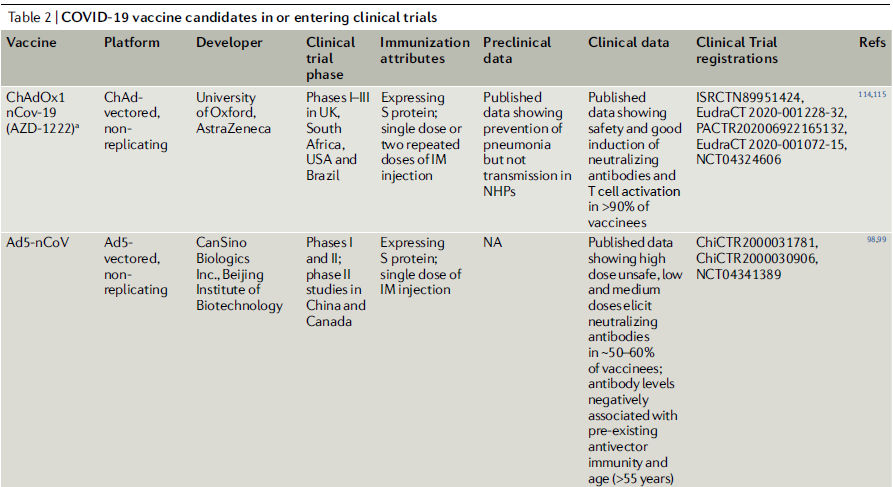
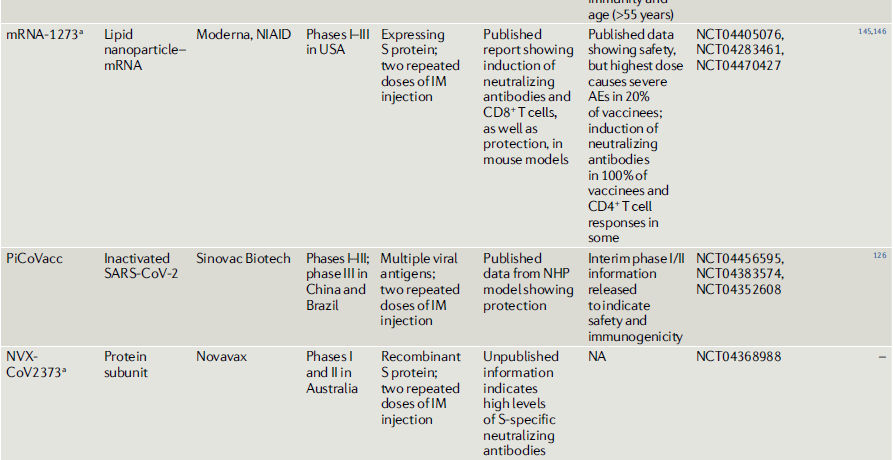
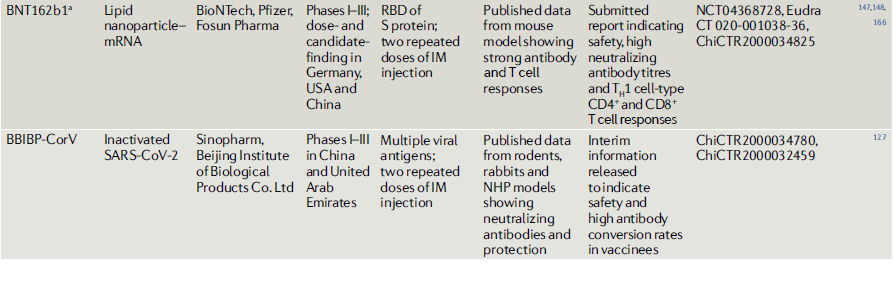
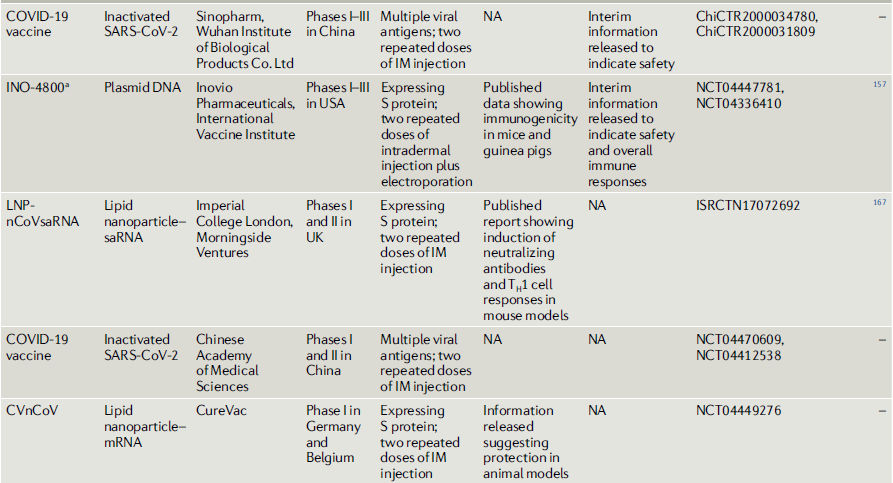
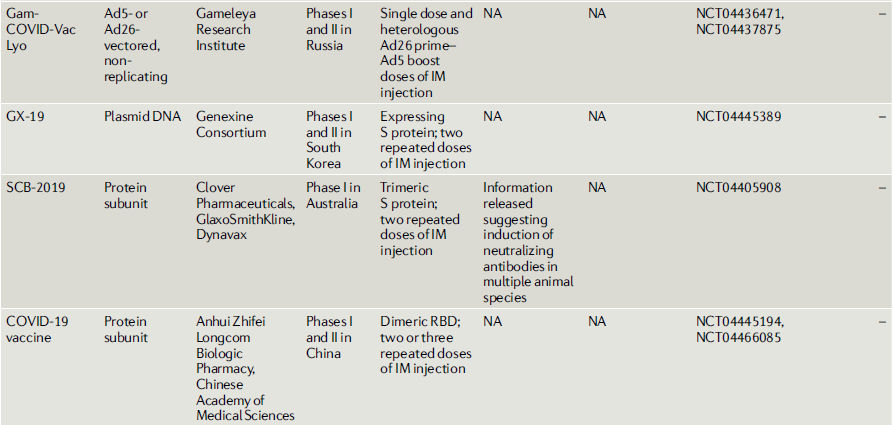
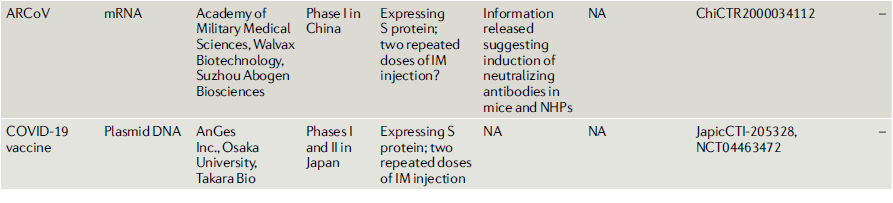
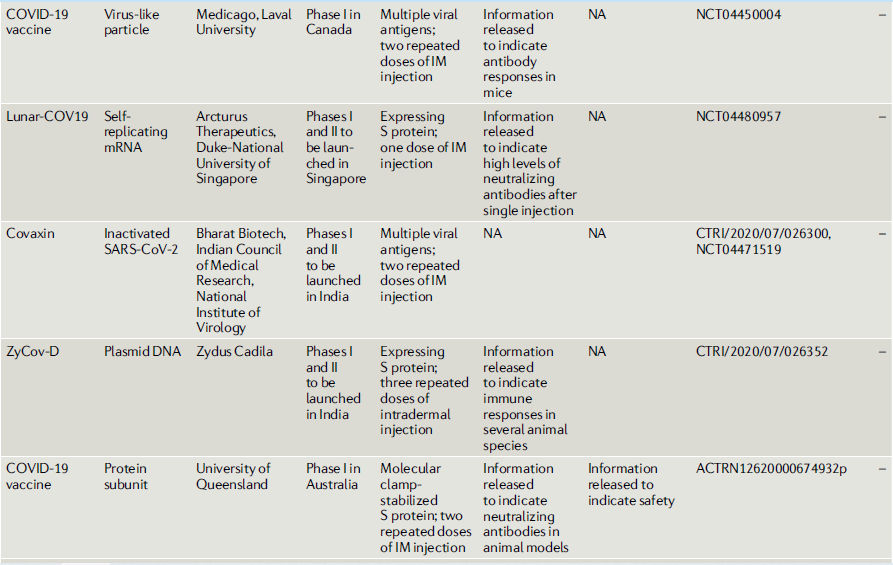
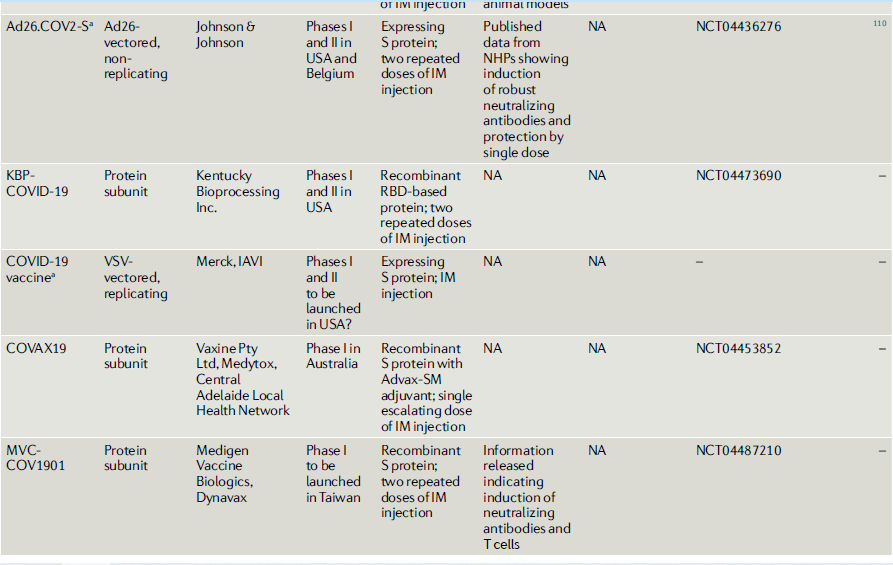
Vacunas recombinantes con vectores virales.
Las vacunas recombinantes con vectores virales se construyen sobre un esqueleto viral de replicación deficiente o un esqueleto viral atenuado con capacidad de replicación preparados por bioingeniería para expresar antígenos derivados del patógeno target . Aunque solo un par de vacunas con vector viral han sido aprobadas para uso humano para el control de infecciones como el ébola, esta plataforma ha sido ampliamente investigada y tiene un historial bien establecido de enfermedades infecciosas y cáncer, dada su maleabilidad genética, seguridad y capacidad para inducir fuertes respuestas de células T sin necesidad de un adyuvante95,96. Algunos vectores virales, como Ad5 y ChAd, por lo general necesitan administrarse solo una vez para su protección y tienen tropismo natural para la mucosa respiratoria, lo que significa que son susceptibles de vacunación por la mucosa respiratoria79. La tecnología ya existe para su producción de grado clínico y almacenamiento a gran escala.
Así, los vectores virales recombinantes son la segunda plataforma más común para el desarrollo de la vacuna COVID-19, con 4 candidatas actualmente en ensayos clínicos (Tabla 2), 38 en desarrollo preclínico5 y 3 (ChAdOx1 nCoV-19, Ad26-S y VSV-S) seleccionadas para la Operación Warp Speed97 de EE. UU. (Tabla 2). Las plataformas virales no replicantes se basan principalmente en Ad5 o MVA, y la mayoría de estas vacunas candidatas expresan la proteína S o RBD del SARS-CoV-2. Los vectores virales con capacidad de replicación se basan principalmente en las cepas vacunales de otros patógenos humanos (como los virus del sarampión o la influenza) o patógenos veterinarios (como el virus de la estomatitis vesicular (VSV)). Sin embargo, será importante considerar si los seres humanos tienen inmunidad preexistente contra la columna vertebral viral (Tabla 1). Los anticuerpos preexistentes pueden afectar la capacidad de dichas vacunas para activar el sistema inmunológico. El uso de estructuras virales como ChAd, para las que los humanos tienen poca o ninguna inmunidad preexistente, puede ayudar a eludir este problema79.
El Ad5-nCOV, que está siendo desarrollado por la compañía china de vacunas CanSino Biologics, está diseñado para inducir anticuerpos neutralizantes de la proteína SARSCoV-2 S después de la inyección intramuscular (Tabla 2). Sin datos preclínicos publicados, entró en ensayos clínicos de fase I / II con tres dosis de vacuna probadas98,99. Es de destacar que estas dosis son de 10 a 30 veces más altas que las utilizadas en ensayos previos de vacunas intramusculares100-102. Mientras que la dosis más alta generó una toxicidad inaceptable y se eliminó del estudio de fase II99, las dosis más pequeñas indujeron anticuerpos neutralizantes específicos de la proteína S en sólo el 50% de los receptores de la vacuna98. El estudio de fase II reafirma en gran medida las observaciones de fase I de que, aunque la vacuna induce respuestas tanto de anticuerpos como de células T, su potencia se reduce por la inmunidad preexistente al Ad5, particularmente en participantes de edad avanzada99. Dependiendo de la región geográfica, del 35 al 95% de los seres humanos tienen niveles circulantes significativos de anticuerpos neutralizantes contra Ad5 103. Esto concuerda con la rápida disminución de los títulos de anticuerpos observados en un estudio de fase II de la vacuna Ad5-Ébola104. La vacuna está entrando en ensayos avanzados en China, Canadá y Chile105.
Johnson & Johnson está desarrollando otra vacuna COVID-19 basada en adenovirus humanos, conocida como Ad26-S, aunque todavía hay un 40% de seroprevalencia para Ad26 en humanos106. Dado que Ad26 es intrínsecamente menos inmunogénico que el Ad5 107, la inmunidad eficaz requiere vacunas repetidas homólogas o heterólogas, como se ha demostrado en los estudios de vacunas Ad26-VIH y Ad26-Ébola en humanos108,109. Sin embargo, una sola administración parenteral de una vacuna COVID-19 con vector de Ad26 (Ad26.COV2.S) ofreció una protección sólida en un modelo de primates no humanos de SARS-CoV-2 110.
ChAdOx1 nCoV-19 (también conocido
como AZD-1222), que está siendo desarrollado por la
Universidad de
Oxford, Reino Unido y AstraZeneca, es la vacuna COVID-19 clínicamente
más avanzada (Tabla 2). Los seres humanos tienen una baja seroprevalencia de ChAd, de ahí su fuerte inmunogenicidad y utilidad
para la vacunación heteróloga de COVID-19 de primer refuerzo79,107,111.
El desarrollo de ChAdOx1 nCoV-19 se basa en estudios prometedores en
humanos con la vacuna ChAdOx1-MERS112 y la vacuna ChAdOx1-TB113. Sin
embargo, aunque la administración intramuscular de ChAdOx1 nCoV-19
redujo la carga viral del SARS-CoV-2 en los pulmones y previno la
neumonía en los macacos rhesus, no redujo la carga viral en el tracto
respiratorio superior114. Un estudio de fase I / II del que se ha
informado recientemente muestra su seguridad y la inducción de potentes
respuestas de anticuerpos neutralizantes y de células T después de una
única inyección parenteral, que se refuerzan aún más con una segunda
vacuna homóloga115. No está claro a partir de este ensayo hasta qué
punto se activaron los subconjuntos de células T CD4 + y CD8 +.
VSV-S es una vacuna COVID-19 con capacidad de replicación en desarrollo por Merck116 y otros grupos. La vacuna de Merck se basa en la licencia de su vacuna VSV-Ébola altamente eficaz, que induce anticuerpos neutralizantes e inmunidad celular contra la glicoproteína de superficie del virus del Ébola117. El VSV es un virus veterinario al que los seres humanos no tienen inmunidad preexistente. Sin embargo, la capacidad de clonación del vector VSV es limitada a 4 kb, y su idoneidad para la vacunación de la mucosa respiratoria no está clara.
Una sola vacunación parenteral con un vector VSV que expresa la proteína S proporciona protección contra el SARS-CoV-2 en modelos de ratón y hámster118,119. Entre otros candidatos con vector viral está el MVA no replicante. El MVA ha sido ampliamente explorado como portador de vacunas y tiene una capacidad de clonación de hasta 30 kb. Sin embargo, como no es fuertemente inmunogénico, el MVA se utiliza a menudo como vacuna de refuerzo o se requiere una inyección repetida para ser eficaz, como fue el caso en las pruebas clínicas de una vacuna MVA-MERS-S120.
Vacunas a virus inactivado
Se han utilizado con éxito virus
inactivados física o químicamente en vacunas humanas contra la
poliomielitis, la hepatitis A y la influenza121,122. Los virus
inactivados pueden generarse y ampliarse rápidamente en una situación de
pandemia utilizando una infraestructura y métodos bien establecidos123.
Las vacunas virales inactivadas tienen pocos problemas de seguridad, a
diferencia de sus contrapartes vivas atenuadas, y expresan una amplia
gama de antígenos virales nativos, incluidos los antígenos de superficie
con conformaciones de epítopo retenidas que pueden inducir respuestas de
anticuerpos dependientes de la conformación124,125.
Actualmente, hay cinco ensayos
clínicos iniciales para evaluar las vacunas inactivadas contra el SARS-CoV-2
(Cuadro 2), con nueve candidatos adicionales en desarrollo preclínico5.
PiCoVacc, una vacuna inactivada contra el SARS-CoV-2 y con adyuvante de alumnio desarrollada por Sinovac Biotech Ltd en China, es el candidato más avanzado con resultados preclínicos publicados126. Protege a los macacos rhesus contra el SARS-CoV-2, con títulos virales reducidos e inmunopatología asociada a anticuerpos contra la proteína S y nucleocápside126.
BBIBP-CorV, otra candidata virus inactivado, que está siendo desarrollada por la estatal china Sinopharm, fue probada en una variedad de modelos animales, con eficacia demostrada en primates no humanos127. Aunque estos hallazgos brindan optimismo, las observaciones se hicieron en estudios bastante a corto plazo y deben interpretarse con cautela.
Las vacunas virales inactivadas a
menudo requieren un adyuvante y una administración repetida para ser
efectivas (Tabla 1). El uso de aluminio como adyuvante126,127 las hace
inadecuadas para la liberación en la mucosa respiratoria128. Aunque la
protección mediada por la inmunización intramuscular con PiCoVacc o
BBIBP-CorV indica algún nivel de inmunidad de la mucosa, probablemente a
través del transporte de anticuerpos sistémicos a los pulmones, la
durabilidad de dicha inmunidad sigue sin estar clara, ya que se realizó
una prueba de desafío con SARS-CoV-2 , 1-4 semanas después de la
vacunación 126,127. Además, de manera similar a las vacunas de subunidades de proteínas, las vacunas virales inactivadas son malos
inductores de células T CD8 + citotóxicas, que probablemente sean
necesarias para una vacuna COVID-19 eficaz.
Los estudios con vacunas inactivadas de SARS-CoV y virus respiratorio
sincicial han reportado un aumento de la enfermedad facilitada (enhancement)
por la
vacuna, probablemente involucrando una respuesta de células TH2 y eosinofilia pulmonar, que puede empeorar en hospedadores de edad
avanzada56,74,129. Aunque PiCoVacc o BBIBP-CorV no empeoraron la
enfermedad pulmonar dentro de los 7 días posteriores a la infección, se
sabe que el aluminio impulsa respuestas inmunitarias mediadas por células
TH2, lo que justifica más investigaciones de seguridad. El uso de
aluminio modificado con sesgo celular TH1 u otros adyuvantes como CpG
puede evitar tales problemas de seguridad130,131.
Vacunas de subunidades proteínas
Actualmente, hay siete vacunas de
subunidad COVID-19 en ensayos clínicos (Tabla 2), con otras 50
candidatas en desarrollo preclínico, lo que la convierte en la
plataforma más común5. Las vacunas de subunidades inducen principalmente
respuestas de anticuerpos y células TH CD4 +. Por lo tanto, la mayoría
de estas vacunas contienen proteína S de SARS-CoV-2 de longitud completa o
porciones de ella con el objetivo de inducir anticuerpos neutralizantes,
de manera similar a la mayoría de las vacunas contra el SARS y el MERS,
que tenían diferentes niveles de eficacia132-134.
Las vacunas de subunidades pueden diseñarse para enfocar la respuesta
inmune hacia epítopos neutralizantes, evitando así la producción de
anticuerpos no neutralizantes que pueden promover el ADE de la
enfermedad135. Sin embargo, a diferencia de las vacunas basadas en
ácidos nucleicos o con vectores virales, las proteínas S recombinantes
en las vacunas de subunidades podrían tener una conformación de epítopo
inadecuada a menos que se produzcan en células de mamíferos136. Las
proteínas o los péptidos solos son poco inmunogénicos y generalmente
requieren no solo un adyuvante, sino también administración repetida, y
son malas activadoras de las respuestas de células T CD8 + (Tabla
1).
Además, esta plataforma generalmente no es adecuada para la vacunación
de la mucosa respiratoria. Como es el caso de las vacunas virales
inactivadas, el uso de aluminio sin modificar como adyuvante sesga la
respuesta inmune hacia respuestas similares a las de las células TH256,
lo cual es indeseable para la defensa del huésped contra el SARS-CoV-2 y
puede tener un papel en el ADE de la enfermedad74,130 . En este sentido,
las vacunas de subunidad COVID-19 que están desarrollando
GlaxoSmithKline y Novavax utilizan adyuvantes AS03 y Matrix-M,
respectivamente 5.
Vacunas de partículas similares a Virus
Las VLP son partículas de
formación espontánea compuestas por varias proteínas virales
estructurales que se coexpresan o mezclan. Varias vacunas comerciales,
como las vacunas contra la hepatitis B y el virus del papiloma humano,
se basan en VLP137. En el caso de los coronavirus con envoltura, las VLP
se forman cuando las roteínas virales S, M y E, con o sin N, se
coexpresan en células productoras eucariotas138,139. Esto da como
resultado una gemación activa de las células productoras de VLP que son
estructuralmente idénticas al virus infeccioso pero carecen del genoma
viral y, por lo tanto, no son infecciosas. La presencia de proteína S en
la superficie de las VLP les permite unirse e ingresar a las células
ACE2 + de la misma manera que el virus parental140. A diferencia de las
vacunas de subunidades, la matriz de proteína S en la superficie de VLP
reticula el receptor de células B y activa directamente las células B,
pero, al igual que las vacunas de subunidades y virales inactivadas, las
VLP también suelen requerir un adyuvante y una administración
repetida137. A pesar de esto, la tecnología VLP está bien establecida,
se comprenden la biología y la seguridad de las VLP de coronavirus y su
producción a gran escala según los estándares de Buenas Prácticas de
Fabricación es relativamente sencilla.
Actualmente, solo hay 1 vacuna COVID-19 basada en VLP en ensayos
clínicos (Tabla 2), con 12 más en desarrollo preclínico5. Estas se
producen in vivo a partir de un vector viral, como MVA, que expresa los
componentes de VLP (una plataforma que está desarrollando
GeoVax) o más
a menudo in vitro a partir de células productoras. En particular,
Medicago, una empresa canadiense, produce sus VLP de SARS-CoV-2 a partir
de plantas modificadas genéticamente. Sus resultados no publicados
parecen sugerir eficacia en la inducción de anticuerpos neutralizantes
en ratones. 141
Vacunas basadas en Acidos
nucleicos
El ADN plasmídico recombinante se
ha explorado como plataforma de vacuna durante décadas, mientras que el
ARNm ha surgido más recientemente como una plataforma
promisoria 142,143. Actualmente, hay 6 vacunas COVID-19 basadas en mRNA
y 4 vacunas COVID-19 basadas en DNA en ensayos clínicos (Tabla 2), con
27 vacunas de este tipo (16 vacunas basadas en mRNA y 11 basadas en DNA)
en desarrollo preclínico5.
El ARNm que codifica el complejo antígeno con un portador, tales como las nanopartículas lipídicas, puede administrarse eficazmente in vivo en el
citoplasma de las células huésped para la traducción de proteínas y
modificaciones postransduccionales142,144, lo que es una ventaja sobre las
vacunas de subunidades de proteínas recombinantes. Las vacunas de ARNm
no son infecciosas y se sintetizan mediante transcripción in vitro,
libres de moléculas microbianas. Estas características beneficiosas
diferencian a las vacunas de ARNm de las vacunas virales vivas
atenuadas, las vacunas virales inactivadas, las vacunas de subunidades y
las vacunas recombinantes con vectores virales en términos de seguridad,
eficacia y cuestiones de inmunidad antivectorial, lo que permite su
producción rápida y económica y la vacunación repetida142 (Tabla
1).
El ARNm-1273, que es producido por Moderna, una compañía de biotecnología estadounidense que tiene experiencia con vacunas MERS basadas en ARNm, codifica una proteína S de SARS-CoV-2 estabilizada prefusión encapsulada en nanopartículas lipídicas. Entró en pruebas clínicas incluso antes de la publicación de los datos preclínicos145. Los datos de ensayos clínicos de fase I publicados recientemente indican que las dosis bajas y medias de dos inyecciones parenterales repetidas son generalmente seguras e inducen fuertes respuestas de anticuerpos específicos de la proteína S y una respuesta de linfocitos T principalmente CD4 + en la mayoría de los participantes del ensayo146. Pfizer y BioNTech también están evaluando una vacuna de nanopartículas de ARNm-lípidos que codifica la proteína S RBD (conocida como BNT162b1) en humanos, que desarrollaron un sólido anticuerpo específico de la proteína S y respuestas de células T CD4 + y CD8 + después de dos inyecciones parenterales repetidas147,148. Las vacunas Pfizer / BioNTech y Moderna han sido seleccionadas para la Operación Warp Speed97 de EE. UU. (Tabla 2).
Las vacunas Pfizer y Moderna han sido recientemente autorizadas por FDA para uso humano, su potencial está respaldado por estudios previos sobre la influenza, la rabia y las infecciones por el virus del Zika en animales149-153. Por ejemplo, una vacuna de ARNm para el virus de la influenza indujo inmunidad humoral a largo plazo en ratones jóvenes y ancianos149, y una vacuna de ARNm para el virus del Zika indujo tanto anticuerpos como células T CD8 + citotóxicas en ratones154. Sin embargo, dos estudios clínicos muestran disparidades en la magnitud y la longevidad de las respuestas inmunitarias inducidas por las vacunas de ARNm152,155. Por lo tanto, aunque las vacunas COVID-19 basadas en ARNm se muestran prometedoras a partir de las primeras pruebas clínicas, quedan dudas sobre su eficacia protectora en humanos. Tampoco está claro si las vacunas de ARNm son susceptibles de ser administradas por la mucosa respiratoria.
Las vacunas de ADN plasmídico comparten varias características con las vacunas de ARNm, incluida la seguridad, la facilidad de producción y la escalabilidad156. Sin embargo, son poco inmunogénicas y requieren múltiples dosis y la adición de un adyuvante. Actualmente, hay cuatro vacunas COVID-19 basadas en ADN plasmídico en pruebas clínicas (Tabla 2), con 11 más en desarrollo preclínico. INO-4800, una vacuna de ADN plasmídico que expresa la proteína S de SARS-CoV-2 está siendo desarrollada por la empresa biotecnológica estadounidense Inovio Pharmaceuticals. Un estudio preclínico en ratones y cobayas examinó la inmunogenicidad de esta vacuna, pero no proporcionó datos relacionados con la protección frente a la exposición157. Dos inyecciones repetidas de una vacuna de ADN plasmídico que expresa la proteína S dieron como resultado una sólida inmunidad protectora en los macacos rhesus158.
Conclusiones y Perspectivas
El mundo tiene una gran necesidad
de estrategias de vacunación COVID-19 seguras y eficaces. Muchos
laboratorios y empresas se han apresurado a desarrollar rápidamente
estas vacunas, lo que ha dado lugar a más de 160 candidatos a vacunas, y
unos pocos han entrado en ensayos clínicos de fase I, II y III en un
breve período de 6 meses. Aunque apenas estamos comenzando a comprender
COVID-19 y sus requerimientos de vacunas, la mayoría de las plataformas de
vacunas avanzadas se han explorado ampliamente para otras infecciones y
cáncer79,95,96,159. Si bien es importante seguir varias estrategias de
vacunas en paralelo, es igualmente importante no perder de vista este
conocimiento científico existente para tomar decisiones bien informadas
sobre qué estrategias priorizar.
Las diversas plataformas y estrategias de vacunas tienen sus pros y sus contras inmunológicos (Tabla 1), pero los principios inmunológicos modernos y los datos de estudios previos de plataformas similares nos llevan a suponer que una estrategia de vacuna parenteral COVID-19 capaz de inducir una respuesta robusta y duradera que involucra tanto los anticuerpos neutralizantes como las células T deberían proporcionar un nivel significativo de protección.
Casi todas las vacunas actuales en el programa de inmunización humana se administran a través de la piel o el músculo, y la mayoría de las estrategias actuales de vacuna COVID-19 también se enfocan en la vía parenteral de vacunación (Tabla 2). Suponemos además que una estrategia de vacuna de la mucosa respiratoria capaz de inducir estas respuestas directamente en la mucosa respiratoria será más eficaz en el control temprano o la eliminación del SARS-CoV-2. Esto es particularmente relevante para las poblaciones de ancianos de alto riesgo, que requerirán una estrategia de vacunación particularmente sólida. En este sentido, una estrategia de vacunación de la mucosa respiratoria para COVID-19 puede basarse en la experiencia exitosa en la administración de vacunas contra la influenza, el sarampión y la tuberculosis a los seres humanos por las mucosas respiratorias160-162.
La vacunación de la mucosa respiratoria también
tiene la ventaja de que no requiere agujas y requiere una dosis mucho
menor que la vía parenteral. Sin embargo, en comparación con la vía
parenteral, menos plataformas de vacuna son seguras y eficaces para la
vacunación de la mucosa respiratoria. Además, el uso de dispositivos de
inhalación para la administración de la mucosa respiratoria puede ser
potencialmente un factor limitante para la aplicación generalizada en
entornos de escasos recursos.
De acuerdo con el paradigma de desarrollo de vacunas pandémicas (Figura
2), los hitos del desarrollo de vacunas convencionales se comprimen de
un período de tiempo de 10 a 15 años a 1 a 2 años, con procesos
preclínicos, clínicos y de fabricación a gran escala superpuestos que
ocurren en paralelo6. Debido al proceso de desarrollo acelerado, los
datos provisionales de los estudios clínicos y preclínicos de vacunas en
curso se están publicando casi en tiempo real. Como resultado, no se
dispone de información crucial sobre la longevidad y la calidad de la
inmunidad protectora inducida por vacunas. Dado que las tasas de
transmisión y el número de casos nuevos se han reducido en muchos
países, es incierto si los estudios de fase II y fase III de los
candidatos líderes llegarán a una conclusión fiable con respecto a su
eficacia protectora.
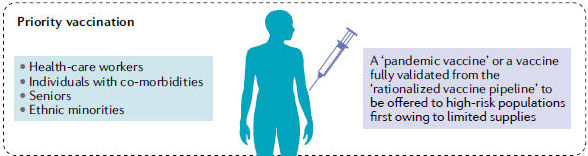
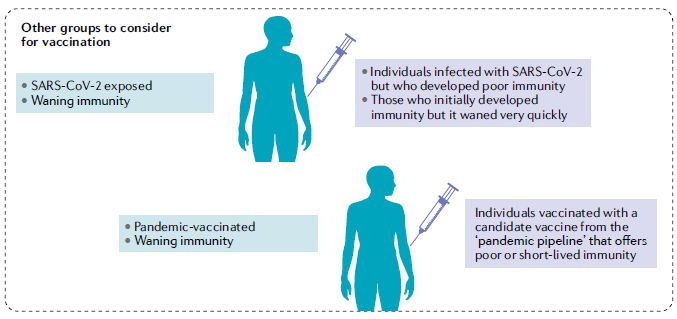
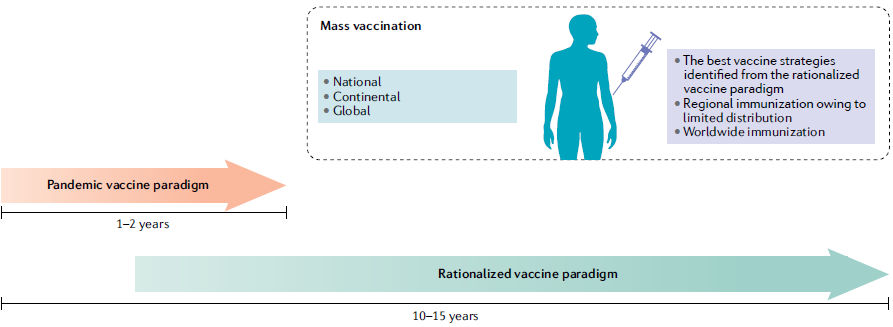
Figura 2 .- Escenarios en evolución para el desarrollo y la demanda global de la vacuna COVID-19. En respuesta a la demanda urgente de una vacuna, más de dos docenas de vacunas candidatas están avanzando a través de ensayos clínicos siguiendo un paradigma de desarrollo acelerado de vacunas pandémicas, y muchos pasos del proceso de desarrollo ocurren en paralelo antes de que se confirme el resultado exitoso de los pasos anteriores. Los candidatos a vacunas continuarán siendo evaluados preclínicamente y clínicamente siguiendo procesos de desarrollo de vacunas convencionales y / o racionalizados durante los próximos años. Estos esfuerzos evolucionarán para satisfacer las demandas de vacunación en varios escenarios probables que se pronostican sobre la base de los desafíos sociopolíticos y los datos emergentes sobre la trayectoria de la pandemia de la enfermedad por coronavirus 2019 (COVID-19) y la respuesta del huésped al síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2).
Un escenario es la vacunación prioritaria de poblaciones de alto riesgo, como trabajadores de la salud, personas mayores, personas con comorbilidades y minorías étnicas, que han sido afectadas de manera desproporcionada por COVID-19, cuando el suministro de vacunas es inicialmente limitado. Aparte de estos grupos priorizados, también puede ser necesario considerar que las personas asintomáticas, los pacientes que se han recuperado de COVID-19 pero generaron una inmunidad deficiente o cuya inmunidad disminuyó rápidamente, y las personas que recibieron una vacuna 'pandémica' de rápido desarrollo que proporcionó una protección subóptima o las respuestas inmunitarias que disminuyen rápidamente pueden requerir una vacuna de refuerzo (booster) para asegurar niveles suficientes de protección de la población para la inmunidad colectiva. En última instancia, las poblaciones regionales, continentales y mundiales estarán sujetas a programas de vacunación masiva basados en el alcance de la distribución de vacunas nacional y mundial y también probablemente de acuerdo con la gravedad regional relativa de los brotes.
Además, estos candidatas a vacunas se han estudiado de forma aislada, lo que dificulta la comparación directa de la eficacia de diferentes candidatos. Por lo tanto, sería prematuro aclamar la seguridad e inmunogenicidad observadas en los ensayos de la vacuna COVID-19 como un verdadero éxito. En gran medida, estos resultados podrían anticiparse a partir de estudios anteriores que prueban las mismas plataformas y rutas de entrega. No obstante, puede ser necesario el despliegue rápido de una vacuna con datos preclínicos de eficacia pero datos clínicos limitados en poblaciones de alto riesgo (Figura 2).
El proceso evolutivo de desarrollo de vacunas continuará durante los próximos años hasta que se completen más ensayos clínicos, se evalúen estrategias de vacunas adicionales y se comprenda mejor la defensa del huésped contra el SARS-CoV-2, incluida la inmunidad postinfección (Fig. 2). Probablemente no será hasta entonces que la inmunización masiva global se convierta en una realidad. Es posible que las poblaciones que reciben la primera ronda de vacunas tengan una inmunidad menguante y requieran refuerzo con vacunas mejoradas de COVID-19 de segunda generación. Además,en adición a las personas no expuestas, algunas personas que se han recuperado del COVID-19 que desarrollan una inmunidad deficiente o menguante también pueden requerir la vacunación163.
Dados los desafíos en los recursos, la fabricación y los problemas asociados con la distribución y el proteccionismo regional, la implementación de los programas de vacunación probablemente será desigual, asincrónica y variable, involucrando diferentes plataformas y estrategias de vacunas en todo el mundo164,165. En este sentido, algunos países ricos en recursos ya se han asegurado un gran número de dosis de diferentes vacunas candidatas sin saber cuál puede resultar eficaz. El acalorado debate ha comenzado a nivel mundial sobre quién debería estar al frente de la línea cuando el suministro de vacunas es limitado. La fundación de COVID-19 Vaccines Global Access (COVAX) Facility por Gavi, la Coalition for Epidemic Preparedness Innovations (CEPI) y la OMS es un intento de reunir recursos y unir a los países de ingresos más altos y más bajos para lograr un proceso coordinado, rápido y acceso transparente y equitativo a las vacunas COVID-19 en todo el mundo.