
Ecocardiografía funcional
Julio 2011
Ecocardiografía funcional realizada por Neonatólogo en UCIN
Afif El-Khuffash, Patrick McNamara Department of Neonatology, Hospital for Sick Children, Canada Seminars Fetal & Neonatal Medicine 2011
Traducción Dr Gerardo Flores H Pediatra Neonatólogo Puerto Montt Chile
1.
- Introducción
Los neonatólogos utilizan cada vez más el ultrasonido al lado de la cabecera en el entorno de cuidados intensivos para respaldar las decisiones clínicas. La tecnología se puede aplicar a la evaluación del corazón, cerebro, abdomen / pelvis neonatal y para facilitar el acceso vascular. Esta revisión se enfocará principalmente en la ecocardiografía funcional realizada por un neonatólogo. La provisión de información en tiempo real sobre el rendimiento cardiovascular y la hemodinámica sistémica, la naturaleza no invasiva de la técnica, la rapidez de adquisición de datos , la generación de reportes y la capacidad de realizar evaluaciones funcionales longitudinales han contribuido al uso creciente de la ecocardiografía funcional por neonatólogos en UCIN . La falta de una medida confiable del flujo sanguíneo sistémico es un ejemplo de una situación clínica que ha llevado a los neonatólogos a realizar exámenes de ecocardiografía al lado de la cabecera. Signos clínicos tales como la frecuencia cardíaca, presión arterial y el tiempo de llene capilar, en los que tradicionalmente se han basado los médicos, proporcionan información limitada sobre la adecuación del flujo sanguíneo sistémico y la perfusión del órgano.1
Por último, los problemas de acceso a Ecocardiografía o un servicio de cardiología pediátrica impulsó a los neonatólogos a desarrollar estas habilidades avanzadas. Esta revisión examina el posible rol clínico de los métodos de ultrasonido en la UCIN; específicamente, sus aplicaciones en diferentes estados de enfermedad y cómo la tecnología puede ser introducida de manera segura en la UCIN.
2.- Evolución de Ecografía en la UCIN
El uso de ultrasonido al lado de la cabecera para la evaluación del sistema cardiovascular en el contexto de la toma de decisiones clínicas está ganando gran interés. En el entorno de atención aguda, los no especialistas en ultrasonido pueden ser entrenados para proporcionar imágenes y mediciones enfocadas. Este enfoque no pretende reemplazar las evaluaciones estructurales detalladas proporcionadas por los servicios de consulta, tales como la cardiología o la radiología. Está diseñado para apoyar el juicio clínico y proporcionar una mejor comprensión de los procesos fisiológicos, y monitorear la respuesta al tratamiento; este enfoque, que combina el examen clínico y la ecocardiografía de cabecera, ha demostrado mejorar el diagnóstico clínico y el manejo del paciente2. El examen de ultrasonido de cabecera suele ser dirigido y enfocado hacia un problema clínico específico. Por lo general, es significativamente más corto que una evaluación de ecocardiografía tradicional, lo que minimiza la manipulación del paciente. En las unidades de cuidados intensivos para adultos, el uso habitual de la ecocardiografía transesofágica es una práctica común.
El uso de esta técnica por parte de intensivistas adecuadamente entrenados puede cambiar el manejo del 30% de los pacientes basado en los resultados, y en un 10% puede detectar diagnósticos graves previamente desconocidos 3. El surgimiento de esta modalidad en la UCIN se originó por las limitaciones de la evaluación clínica en el monitoreo cardiovascular y proporcionar información precisa sobre el flujo sanguíneo sistémico. Además, la complejidad y la naturaleza dinámica de la circulación transicional, la respuesta variable del miocardio inmaduro en el período neonatal temprano, la presencia de shunt intracardíaco y del ductus arterioso persistente (DAP) hace que la toma de decisiones terapéuticas solo con la evaluación clínica sea desafiante.
La ecocardiografía se usa de forma rutinaria en el neonato para evaluar la estructura del corazón. Sin embargo, obtener estos examenes depende de la disponibilidad de cardiólogos o del acceso a las técnicas de ecocardiografía. Estas exploraciones suelen centrarse en la anatomía cardíaca y solo proporcionan una imagen limitada del rendimiento cardiovascular. Sin embargo, este enfoque es inadecuado para la evaluación del estado hemodinámico y puede no satisfacer las necesidades continuas de los recién nacidos críticamente enfermos en la UCIN.
Además, evaluar la respuesta a las intervenciones terapéuticas requiere una evaluación continua por ultrasonido 4. Existe evidencia creciente de que el uso rutinario de la ecocardiografía funcional en la unidad neonatal identifica el compromiso cardiovascular, cambia el manejo 5 y potencialmente mejora los resultados a corto plazo. La introducción de un programa de screening realizado por un neonatólogo para ductus arterioso hemodinámico significativo (HSDA) el día 3 de vida con intervención dirigida se asoció temporalmente con una reducción en la tasa de hemorragia intraventricular grave y la duración de la ventilación6.
Además, Lee et al. mostró que la ecocardiografía portátil por un neonatólogo puede proporcionar un método rápido y preciso para identificar un DAP con una sensibilidad del 87% y una especificidad del 71% 7.
Estudios recientes también han demostrado que la ecocardiografía en la unidad neonatal tiene un alto rendimiento para el diagnóstico de la enfermedad cardíaca estructural y el deterioro del rendimiento cardíaco, a menudo resultante en un cambio de manejo.
Moss et al. reportaron una tasa de concordancia completa del 82% entre las
exploraciones realizadas por neonatólogos entrenados y una evaluación de
cardiólogos pediátricos.8 Samson et al. reportaron tasas de concordancia
similares en su estudio.9 Las preocupaciones planteadas por los cardiólogos
pediátricos sobre la fiabilidad de algunas mediciones hemodinámicas son válidas.
Sin embargo, debe reconocerse que la interpretación de las mediciones
hemodinámicas individuales en forma aislada o sin una cuidadosa consideración de
su aplicación al contexto clínico es probable que conduzca a conclusiones
erróneas. Es probable que la ecocardiografía funcional tenga un mayor impacto
cuando la evaluación ecocardiográfica es de alta calidad, exhaustiva y
cuidadosamente integrada dentro del escenario clínico.
3.- Técnicas de Ultrasonido
3.1.- Imagenología del neonato
La evaluación ecocardiográfica del recién nacido es complicada por cuestiones relacionadas con el tamaño del paciente y las ventanas acústicas transtorácicas. La interpretación de los datos hemodinámicos depende totalmente de la calidad de las imágenes, por lo que la competencia del operador es importante. Las exploraciones en serie del mismo paciente deberían ser realizadas idealmente por un examinador para limitar la variabilidad interobservador y maximizar el beneficio del paciente.
La ecocardiografía funcional incluye la evaluación del corazón utilizando el Doppler de onda pulsada (PWD) bidimensional (2D), el Doppler de onda continua (CWD) y los métodos de modo m. Hay muchos desafíos que enfrenta el ecografista, particularmente en el contexto de los bebés prematuros. Como se destacó anteriormente, la obtención de imágenes de alta calidad es esencial, especialmente cuando se realiza una interrogación Doppler de los vasos para evaluar el flujo sanguíneo.
En los prematuros, la calidad de la imagen puede verse comprometida en presencia de pulmones hiperinsuflados. Los neonatos con diagnóstico por imágenes de displasia broncopulmonar a menudo presentan un desafío particular ya que los campos pulmonares hiperinsuflados o las áreas de atrapamiento de aire pueden tapar el corazón, limitando la adquisición de imágenes adecuada. Además, los prematuros pueden descompensarse con un manejo excesivo o compresión del tórax por el posicionamiento excesivo de la sonda para adquirir imágenes. Todos los esfuerzos deben dirigirse a limitar la duración de estos estudios, con el objetivo de reunir toda la información necesaria mientras se considera la estabilidad del paciente.
3.1.1.- Métodos bidimensionales
Las imágenes bidimensionales son la modalidad más común y se utilizan generalmente para ilustrar la anatomía estructural del corazón. La sonda de ultrasonido envía un haz de barrido de un lado a otro a lo largo de un plano particular del corazón para generar la imagen 2D. La velocidad de cuadros de la sonda es la cantidad de barridos por segundo. Para generar imágenes perfectas del miocardio en movimiento, la velocidad de cuadros debe ser más rápida que la frecuencia cardíaca del neonato. La sonda más comúnmente utilizada en la ecocardiografía es el escáner curvilíneo. Este proporciona un amplio campo de visión tanto cerca de la sonda como en profundidad. La frecuencia de las ondas de ultrasonido determina la calidad y la resolución de la imagen. Las frecuencias más altas proporcionan una resolución de imagen mejorada, pero la menor potencia admisible en los neonatos limita la profundidad de la imagen. Por el contrario, las frecuencias más bajas pueden llegar más profundamente al tejido, pero con una resolución de imagen más pobre. En los recién nacidos a término y prematuros, un rango de frecuencia de la sonda de 7.5 - 10 MHz proporciona una excelente resolución con una penetración adecuada en el tejido (Figura 1).

Figura 1. -
Ventanas y vistas ecocardiográficas comunes utilizadas en ecocardiografía
funcional. LA, left atrium; RA, right atrium; Mv,
mitral valve; Tv, tricuspid valve; LV, left ventricle; RV, right ventricle; Ao,
Aorta; RPA, right pulmonary artery; Desc Ao, descending aorta; PDA, patent
ductus arteriosus.
3.1.2.- Métodos m-Mode
El escaneo m-Mode interroga el movimiento del tejido a lo largo de una sola línea con respecto al tiempo. La base de tiempo se muestra de forma lateral, perpendicular a la línea de interrogación. La pantalla de visualización representa cada eco reflejado a lo largo de una línea. Los ecos estacionarios se representan como una línea plana recta a lo largo de la pantalla y los ecos en movimiento se representan como líneas curvas que reflejan el movimiento en relación con el tiempo. Las aplicaciones clínicas de la ecocardiografía en modo m incluyen la evaluación del tamaño de la cámara, el grosor de la pared, el movimiento valvular y la cuantificación de la contractilidad miocárdica (Figura 2).
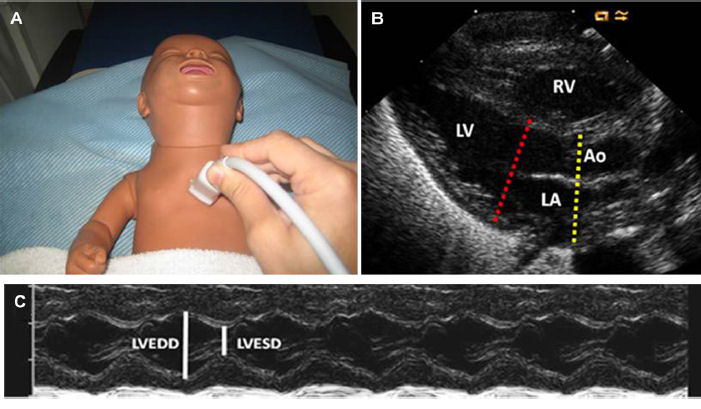
Figura 2. - Vista paraesternal del eje largo del ventrículo izquierdo. La imagen muestra la posición de la sonda (A) y la imagen de eco muestra la vista correspondiente (B). LA: Ao se puede medir usando esta vista para obtener un trazado en modo m (línea amarilla). m-Mode también se puede usar para medir la fracción de acortamiento como se demostró (C) (línea roja). RV, right ventricle; LV, left ventricle; Ao, aorta; LA, left atrium; LVEDD, left ventricular end-diastolic diameter; LVESD, left ventricular end-systolic diameter.
3.1.3.- Imagenologia Doppler
El efecto Doppler es el término dado al cambio en la frecuencia de una onda experimentada por un objeto cuando hay un movimiento relativo entre el objeto y el transmisor de onda. En la ecocardiografía, el transmisor (sonda de ultrasonido) siempre está estacionario en relación con las células sanguíneas en movimiento. Tradicionalmente, la ecocardiografía basada en Doppler se ha utilizado en la práctica clínica para evaluar el flujo sanguíneo. La sonda de ultrasonido estacionaria emite ondas que se reflejan por el movimiento de la sangre y son recibidas nuevamente por la sonda. La frecuencia de las ondas emitidas es diferente de las reflejadas de vuelta al receptor dentro de la sonda. Cada célula en movimiento genera su propia señal Doppler que se dispersa en todas las direcciones. Las señales se reflejan de nuevo en la sonda de ultrasonido por millones de células sanguíneas. La diferencia de frecuencias se expresa entonces como un tono audible y una velocidad en la pantalla. Las aplicaciones clínicas de Doppler incluyen PW, CW y métodos de Doppler de flujo a color.
3.1.4.
-
Doppler
de onda continua
Esta es la más antigua y más básica de las 2 técnicas. El transductor genera CWs con recepción de onda simultánea. La principal ventaja de esta modalidad es la capacidad de medir con precisión el flujo sanguíneo a altas velocidades. Esto es de particular importancia en la evaluación de los RN con un ductus arterioso restrictivo, hipertensión pulmonar y regurgitación tricuspídea, anomalías valvulares o defectos de pared septal. Estas lesiones generalmente tienen velocidades de > 2 m / s, y por lo tanto CW es ideal para el examen del pattern de flujo anormal completo (Figura 3).
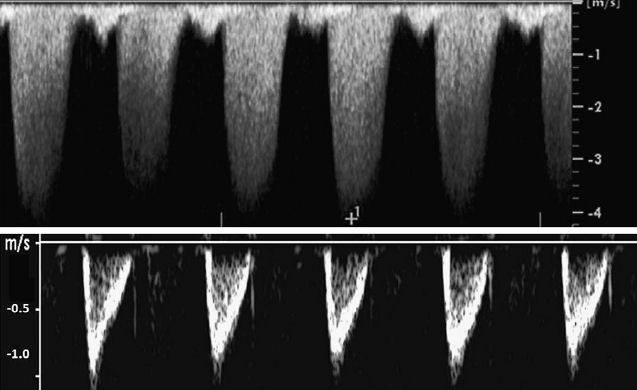
Figura 3. - Doppler de onda continua de regurgitación tricuspídea. El chorro regurgitante se caracteriza por un flujo turbulento representado por una envoltura Doppler completa (panel superior). La velocidad máxima del chorro regurgitante fue de 4.0 m / s, lo que da como resultado un gradiente de presión de 64 mmHg (ver texto). La forma de onda difiere del patrón laminar que se observa en los vasos principales, como la arteria pulmonar principal (panel inferior).
Conocer la velocidad peak del flujo sanguíneo entre 2 cámaras facilita la evaluación del gradiente de presión (ej; entre ventrículo derecho y aurícula derecha). La ecuación de Bernoulli relaciona la diferencia de presión entre 2 cámaras con la velocidad del fluido que pasa entre ellas. La velocidad máxima del jet o chorro de regurgitación se mide usando CW Doppler. Esto se puede convertir en una caída de presión aplicando la ecuación de Bernoulli modificada10 :
presión (mmHg) = 4 x velocidad 2 .
CW es limitada ya que carece de selectividad y reconocimiento de profundidad. Debido a su naturaleza continua, no hay ninguna disposición para el control o la interrogación selectiva de una muestra en particular. La salida de CW contiene información sobre el movimiento de cada célula sanguínea a lo largo de su haz.
Las máquinas modernas de ecocardiografía poseen las funciones de alternancia de imágenes bidimensionales con Doppler CW, lo que permite al operador evaluar objetivamente una válvula o patrón de flujo en particular. Esta conmutación se realiza a velocidades extremadamente altas, dando al operador la impresión de que ambos estudios se realizan simultáneamente. Durante el período Doppler, la visualización de la imagen se genera a partir de datos previamente almacenados de ciclos anteriores. De manera similar, durante el período de imágenes bidimensionales no se recopila información Doppler y toda la información que se muestra proviene de ciclos anteriores, lo que aumenta el ruido de la señal y las tasas de falsos positivos.
3.1.5.- Doppler de onda pulsada
Esta modalidad alterna la transmisión y la recepción del haz de ultrasonido. La principal ventaja es la capacidad de interrogar a un área pequeña a una profundidad particular. La ubicación del volumen de muestra está controlada por el operador. Una de las principales ventajas del Doppler PW es su capacidad para proporcionar datos de desplazamiento Doppler selectivamente desde un pequeño segmento a lo largo del haz de ultrasonido, denominado "volumen de muestra". La ubicación del volumen de muestra está controlada por el operador. Solo se muestran los rayos de ultrasonido reflejados desde el volumen de muestra elegido. Todos los otros rayos reflejados desde diferentes profundidades son ignorados. Desafortunadamente, el Doppler PW no puede medir con precisión velocidades > 1.5 - 2 m / s debido a la ocurrencia de uso general para ubicar con precisión la posición del patrón de flujo anormal, mientras que el Doppler CW se usa para evaluar con precisión la velocidad del flujo en cuestión.
3.1.6.- Doppler de flujo a color
Esta es una instalación presente en todas las máquinas modernas de ecocardiografía que superpone el color en tiempo real sobre las imágenes en 2D para representar el flujo de sangre. Tradicionalmente, la sangre que fluye hacia la sonda se representa en rojo y el flujo que se aleja de la sonda en azul. La característica es extremadamente útil para identificar áreas de aceleración de flujo o regurgitación a través de válvulas, defectos septales o shunt transductal.
4.- Aplicación actual en evaluación hemodinámica y práctica clínica
4.1.- Evaluación de función miocárdica , hipovolemia y perfusión de órgano
La hipotensión sistémica es un problema relativamente común que afecta aproximadamente1/3 de los prematuros con hasta 40% que reciben vasopresores. 11 La dependencia excesiva de los neonatólogos de la presión arterial aislada como marcador sustituto de la adecuación del flujo sanguíneo sistémico es problemática por varias razones . En primer lugar, el umbral arbitrario de presión arterial media que se aproxima a edad gestacional propuesto en 1992 es una simplificación fisiológica que carece de validación científica. En segundo lugar, la perfusión de órganos terminales depende del flujo sanguíneo sistémico y de la resistencia vascular; por lo tanto, la confianza en las mediciones de la presión arterial por sí sola proporciona información limitada con respecto a la suficiencia del flujo sanguíneo del órgano.4
La pobre correlación entre
presión arterial y gasto del ventrículo izquierdo en el primer día de
vida enfatiza este punto12. Además, existe una relación débil entre la presión
arterial y flujo de vena cava superior (VCS) que representa la circulación
del tronco superior, incluido el cerebro13.
Tanto la presión sanguínea como el flujo sistémico son determinantes importantes de la probabilidad de perfusión alterada y ninguno de los 2 debe ser monitoreado ni tratado de forma aislada, sin considerar la influencia del otro.
Finalmente, la ecocardiografía seriada ofrece el potencial de nuevos conocimientos dada la naturaleza fisiológica de la insuficiencia cardiovascular : específicamente, si la preocupación se relaciona con precarga, poscarga o contractilidad miocárdica.
4.1.1.
- Evaluación de gasto cardíaco
La evaluación Doppler de los débitos ventricular izquierdo (LVO) y derecho (RVO) proporciona información hemodinámica adicional con respecto a la suficiencia del flujo sanguíneo. La evaluación de LVO implica medir la velocidad promedio del flujo sanguíneo a través de la aorta ascendente desde una vista apical de 5 cámaras utilizando Doppler PW y determinar el diámetro de la raíz aórtica desde una vista paraesternal de eje largo utilizando método m-mode (Figura 4) .
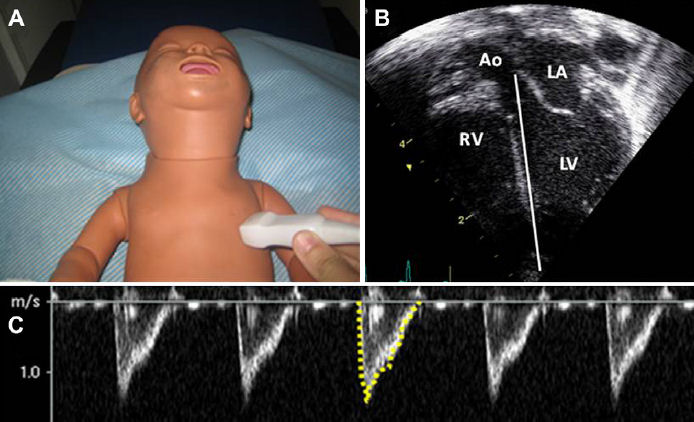
Figura 4.- Posición del Transductor (A) y visión apical de eje largo del corazón (B). Mediciones Doppler onda pulsada de flujo sanguíneo a través de valvula aórtica (línea blanca). Luego se traza el área bajo la curva para obtener la integral velocidad - tiempo (C; línea amarilla). RV, right ventricle; LV, left ventricle; Ao, aorta; LA, left atrium.
La máxima velocidad aórtica ascendente y descendente en prematuros suele ser < 2.0 m / s en ausencia de enfermedad valvular y, por lo tanto, el Doppler PW se recomienda para el análisis.
La velocidad aórtica media se puede medir con sonda Doppler. El área bajo la forma de onda del latido sistólico aórtico puede usarse para calcular la integral veloidad- tiempo (VTI), la cual es una medida de la distancia recorrida por la sangre durante un latido dado (Figura 4 C). Multiplicar eso por el área de la sección transversal aórtica (AoCSA) derivada de ¶ x diámetro aórtico 2 / 4 da el volumen sistólico (volumen stroke).
Fisiología cardiovascular : volumen stroke (SV) es el volumen de sangre bombeada desde el ventrículo izquierdo por latido. El volumen sistólico se calcula usando mediciones de volúmenes de ventrículo de un ecocardiograma y restando el volumen de sangre en el ventrículo al final de un latido (llamado volumen telesistólico o de fin de sístole) del volumen de sangre justo antes del latido (llamado volumen de fin de diástole). Los volúmenes stroke para cada ventrículo son generalmente iguales, siendo ambos aproximadamente 70 ml en un varón sano de 70 kg.
El volumen sistólico es un determinante importante del gasto cardíaco, el cual es el producto del volumen sistólico x frecuencia cardíaca, y también se usa para calcular Fracción de eyección, que es el volumen sistólico dividido por volumen telediastólico.
LVO puede ser derivado de multiplicar volumen sistólico por frecuencia cardíaca :
LVO = AoCSA x VTI x frecuencia cardíaca / peso
y se expresa en ml / kg / min. Los valores normales oscilan entre 170 y 320 ml / kg / min.14
LVO debe ser usado con precaución ya que puede proporcionar una imagen falsamente tranquilizadora de flujo sanguíneo sistémico aceptable en presencia de HSDA - específicamente(DAP hemodinámicamente significativo) , dado que un shunt de alto volumen de izquierda a derecha causará aumento del retorno venoso pulmonar, de precarga del corazón izquierdo y de volumen stroke, pero a expensas del flujo sanguíneo sistémico.
Se ha demostrado que la medición temprana de LVO después de ligadura de DAP predice el deterioro de inicio tardío en la contractilidad del VI, hipotensión arterial sistólica y necesidad de cardiotropos15. La medición de RVO se realiza utilizando un enfoque similar al descrito anteriormente.
El diámetro de arteria pulmonar se evalúa mejor a partir de una vista paraesternal de eje largo oblicuo. El RV VTI se obtiene a partir de una interrogación Doppler de la misma vista. El RVO (gasto cardíaco derecho) refleja el retorno de sangre desde la circulación sistémica y en ausencia de shunt transauricular grande, refleja el flujo sanguíneo sistémico en RN . Sin embargo, las mediciones de RVO se confunden por la presencia de shunt auricular. Típicamente, los shunts auriculares son mucho más pequeños que los shunts ductales, por lo tanto, el RVO se puede usar como una estimación del flujo sanguíneo sistémico12,14.
Se ha propuesto que el flujo de VCS (vena cava superior) es una mejor medida ecocardiográfica del flujo sanguíneo sistémico, ya que refleja el retorno venoso exclusivo del cerebro y parte superior del cuerpo y no está contaminado por shunts.
El flujo de VCS puede evaluarse mediante ecocardiografía.16 Se utiliza una aproximación subcostal para evaluar las señales Doppler de VCS y se usa una vista supraesternal alta para medir el diámetro de VCS. Dado que 4 / 5 partes del flujo en VCS representan el retorno venoso desde cabeza y cuello, tales mediciones pueden proporcionar nuevas enseñanzas sobre cualquier asociación entre flujo sanguíneo cerebral regional y lesión cerebral.
La reducción del flujo en VCS es común en prematuros en las primeras 24 h, alcanzando un nadir entre 8 y 12 h, lo cual coincide con una mayor resistencia vascular sistémica. El bajo retorno de VCS se asocia con mayor incidencia de hemorragia intraventricular tardía y puede ser un factor en la vía causal del deterioro del resultado del neurodesarrollo en prematuros17,18. Sin embargo, el retorno de VCS refleja el suministro de sangre al cerebro y parte superior del cuerpo y, por lo tanto, no se puede obtener información sobre suministro de sangre al hígado, riñón e intestino.
En segundo lugar, el flujo sanguíneo cerebral está
sujeto a mecanismos autorreguladores intrínsecos y puede que no refleje
verdaderamente el rendimiento cardíaco.19 La medición del diámetro de VCS más
allá de las 48 h de vida es difícil. Además, el diámetro del vaso varía
ampliamente dentro del ciclo cardíaco. Por lo tanto, el autor consideró que un
amplio margen de error habría sido el resultado de cálculos volumétricos.
Groves et al. también han cuestionado la validez de esta medición debido a la alta variabilidad interobservador.20
4.1.2.- Evaluación de performance o Rendimiento miocárdico
4.1.2.1. Rendimiento sistólico
Las diferencias de maduración hacen que el
miocardio
inmaduro sea susceptible a un rendimiento alterado. Estas desventajas
del desarrollo hacen que el miocardio neonatal sea vulnerable durante una lesión hipoxico isquémica o cuando se somete a un compromiso de precarga o postcarga. La
evaluación de la contractilidad del miocardio es desafiante dado que los métodos
actuales son carga dependiente aunque la evaluación seriada puede proporcionar
información valiosa. El neonato inmaduro es particularmente sensible a los
cambios repentinos en la poscarga.21 El período de transición inmediato después
de la eliminación de la placenta de la circulación sistémica y la posterior
ligadura de DAP representan situaciones clínicas en las que la poscarga puede
estar desempeñando un papel importante.
El rendimiento sistólico del ventrículo izquierdo (VI) puede evaluarse mediante la fracción de acortamiento (SF), fracción de eyección o la velocidad media corregida de la velocidad del acortamiento circunferencial de fibras (mVCFc).
Fracción de acortamiento (SF)SF caracteriza la contractilidad del VI utilizando métodos de modo-m desde un eje paraesternal largo o una vista de eje corto del ventrículo izquierdo. Se calcula midiendo el diámetro telediastólico (fin de diástole) del ventrículo izquierdo (LVEDD) y el diámetro telesistólico del ventrículo izquierdo (LVESD) usando un eco de modo m y aplicando la siguiente fórmula :
SF % = (LVEDD - LVESD) x 100 / (LVEDD)
Los valores neonatales normales para SF% son 28 - 40% (Figura 2).
La fracción de acortamiento es una medida poco confiable de la función sistólica del VI en los primeros días de vida ya que las presiones altas del ventrículo derecho deterioran el movimiento de la pared septal ventricular22.
La velocidad media del VI del acortamiento fraccional circunferencial (mVCFc) es una medida ajustada de la poscarga independiente de la precarga de la función del ventrículo izquierdo. Está determinada por el siguiente método23 :
mVCFc = (LVEDC) - (LVESC) / (LVEDC x ETc)
donde LVEDC es la circunferencia de fin de diástole del ventrículo izquierdo, LVESC es la circunferencia de fin de sístole del ventrículo izquierdo y ETc es el tiempo de eyección del ventrículo izquierdo corregido para frecuencia cardíaca (intervalo ET / vORR, donde RR es el tiempo entre latidos cardíacos consecutivos).
La relación estrés - estabilidad es una medida independiente de la carga de la contractibilidad miocárdica24, donde la relación entre el mVCFc y el análisis del estrés de la pared al fin de sístole se examina mediante métodos de regresión lineal. La aplicabilidad clínica de estos marcadores no está bien estudiada en recién nacidos. Sin embargo, hay alguna evidencia de que mVCFc se correlaciona con niveles de troponina cardíaca en el período neonatal temprano.25 Los métodos de Doppler tisular, el seguimiento moteado y otros métodos novedosos de análisis se han estudiado en adultos, pero su aplicación en neonatos sigue siendo poco conocida.
4.1.2.2.- Rendimiento Diastólico
El rendimiento diastólico se altera en el recién nacido, pero su relevancia para la toma de decisiones clínicas no es muy apreciada. El llenado diastólico está influenciado por la compliance de la pared ventricular. En adultos y niños mayores, el flujo transmitral ocurre en 2 fases : una fase precoz de flujo pasivo durante la cual ocurre la mayor parte del llenado y una fase tardía de contracción auricular durante la cual se entrega el tercio restante del retorno venoso al ventrículo. En pacientes con disfunción diastólica, la mayoría del llenado ocurre durante la fase auricular, ya que la pared ventricular rígida impide el flujo pasivo temprano a través de la válvula mitral. El miocardio inmaduro fetal y prematuro se caracteriza por una función diastólica deteriorada.
El Doppler PW se puede usar para examinar
este patrón bifásico de flujo transmitral. La primera fase es la onda temprana
(onda E) y es un resultado del flujo sanguíneo pasivo a través de las válvulas
auriculoventriculares en la diástole temprana. La segunda fase es la contracción
de la onda auricular (onda A ) y es el resultado de la contracción auricular al
final de la diástole. Las velocidades máximas de ondas E y A se comparan como
índice (ratios) . Una relación E: A < 1 indica una disfunción diastólica (que indica un
ventrículo sin compliance). La VTI tranmitral puede medirse para proporcionar una
estimación del flujo a través de las válvulas auriculoventriculares26.
Se ha encontrado que el índice de Tei (o índice de rendimiento del miocardio) es un valioso índice de ecocardiografía cuantitativa de la función ventricular al incorporar tanto el rendimiento sistólico como el diastólico de los ventrículos derecho e izquierdo. Se define como la suma de tiempos de contracción y relajación isovolumétricos divididos por el tiempo de eyección, que requiere la medición del intervalo de tiempo entre el fin y el inicio del flujo mitral o tricúspide (el intervalo "a") y el tiempo de eyección del flujo de salida de VI o RV (el intervalo 'b') .27
El índice de Tei se calcula mediante la fórmula (a - b) / b. El índice Tei es fácil de calcular, reproducible e independiente de la frecuencia cardíaca y la presión arterial. Los valores normales en neonatos sanos oscilan entre 0.25 y 0.38.28 Es relativamente independiente de la edad y también tiene un bajo grado de variabilidad inter e intraobservador29.
El uso de la ecocardiografía funcional
para dirigir la terapia en niños con compromiso hemodinámico requiere una
evaluación integral del rendimiento del miocardio y de la hemodinamia sistémica
debido a las limitaciones de las técnicas individuales y la interdependencia de
estos factores. Por ejemplo, un flujo sanguíneo sistémico bajo en un RN de
6 h puede parecer una consecuencia de la contractilidad del VI deteriorada; sin
embargo, la precarga, la poscarga y la fisiología ductal pueden desempeñar un
papel contribuyente. La evaluación con ecocardiografía seriada para
monitorizar la respuesta al tratamiento puede proporcionar una mejor comprensión
de los factores contribuyentes, guiando así la duración del tratamiento y
minimizando la exposición al fármaco.
4.2. - Evaluación Hemodinámica de DAP y relevancia clínica
Antes de la ecocardiografía, el diagnóstico de DAP dependía de la evolución de los signos clínicos, que incluían: un soplo, aumento de la actividad precordial, amplia presión de pulso y pulsos periféricos salientes. Sin embargo, el diagnóstico de un DAP significativo por ecocardiografía precede al desarrollo de los signos clínicos en una media de 2 días.30 Existe una pobre correlación entre los signos físicos y la presencia de DAP por eco en la primera semana de vida31,32. Pulsos saltones y un soplo pueden estar ausente en hasta el 20% de los niños con DAP.33 Por lo tanto, la ecocardiografía sigue siendo el estándar de oro para el diagnóstico de DAP31. La medición del diámetro ductal interno mediante imágenes bidimensionales y Doppler color permite la predicción temprana de DAP significativo en recién nacidos prematuros.
Aunque un diámetro transductal > 1.5 mm tiene un buen valor predictivo de persistencia ductal, la medición no es sin límites (Tabla 1) .34 El ductus es un vaso dinámico de arquitectura variable, con una respuesta impredecible al tratamiento. No es posible cuantificar directamente la magnitud del flujo transductal, pero el impacto en las circulaciones pulmonar y sistémica es medible. Se pueden utilizar los métodos de ecocardiografía bidimensional y Doppler para realizar una evaluación exhaustiva de la significancia del shunt ductal.
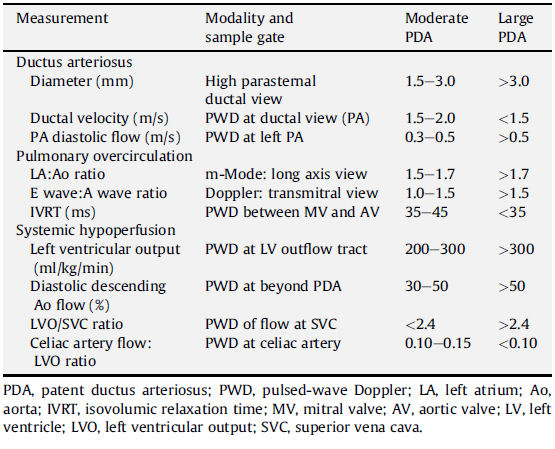
Tabla 1.- Marcadores sustitutos de significancia ductal
4.2.1.- Sobrecirculación Pulmonar
El aumento en el flujo sanguíneo pulmonar efectivo se puede estimar por la relación aurícula izquierda a aorta (LA: Ao), flujo diastólico de arteria pulmonar, tamaño de la cavidad ventricular izquierda, patrones de flujo transmitral y débito del ventrículo izquierdo. LA: Ao usa el diámetro relativamente fijo de la aorta para evaluar el grado de carga de volumen de aurícula izquierda (Figura 2) .35 Esta relación se correlaciona significativamente con el aumento del flujo pulmonar atribuible al flujo transductal excesivo; se ha demostrado que el umbral óptimo de relación ≥ 1.4 predice un DAP significativo.36
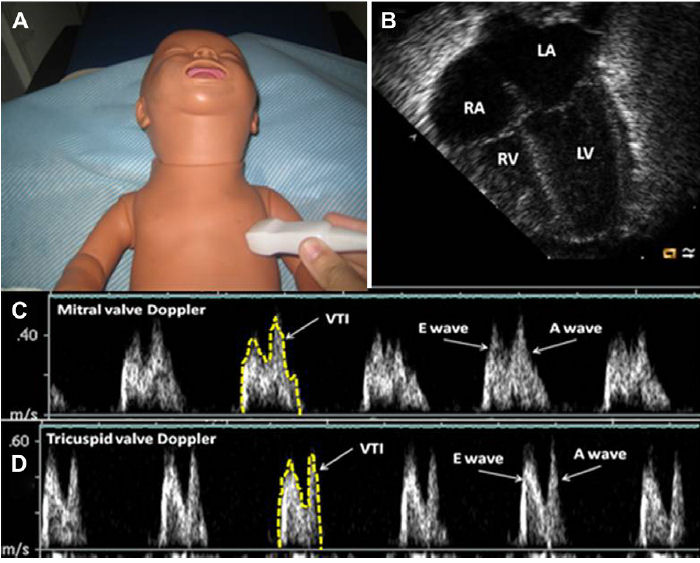
Figura 5.- Evaluación de función diastólica : Se muestran la posición de sonda (A) y la correspondiente vista apical de 4 cámaras (B). Se pueden obtener trazados Doppler de válvulas transmitral (C) y tricúspide (D). Se mide la onda temprana (onda E, flujo sanguíneo diastólico pasivo) y la onda auricular (onda A, flujo debida a contracción auricular). El área bajo la curva (índice de tiempo de velocidad: VTI) también se puede trazar. RV, ventrículo derecho; VI, ventrículo izquierdo; Ao, aorta; RA, aurícula derecha; LA, aurícula izquierda.
La presencia de flujo sanguíneo diastólico en arteria pulmonar izquierda también es un indicador útil de significancia ductal; específicamente, una alta velocidad telediastólica (fin de diástole) representa un gran cortocircuito de izquierda a derecha y un aumento de la perfusión pulmonar37. Marcadores adicionales de aumento de shunt pulmonar también incluyen un alto gasto de VI (> 350 ml / min / kg). Esto indica aumento del retorno venoso pulmonar, precarga del corazón izquierdo y volumen sistólico con aumento compensatorio en el rendimiento del VI.
La medición de flujo Doppler transmitral puede ser un marcador útil de la carga presión / volumen de aurícula izquierda (Figura 5). En el feto en desarrollo y prematuros, la fase temprana del llenado pasivo (onda E) es menor que la fase activa tardía (onda A) lo que causa relación de onda E: A < 1.0. Esto se relaciona con la inmadurez del desarrollo del miocardio pretérmino, que causa mala compliance del miocardio y deterioro del rendimiento diastólico, limitando el flujo pasivo. Esto difiere del patrón observado en el recién nacido, niño y adulto joven a término donde la mayoría del flujo transmitral ocurre en la fase pasiva temprana, de modo tal que el índice E: A es > 1. 26 En recién nacidos con DAP hemodinámicamente significativo, un aumento en el flujo transmitral pasivo se produce secundariamente a presión de aurícula izquierda aumentada lo que causa una pseudonormalización de la relación E: A que puede ser > 1.0, similar al patrón observado en pacientes más maduros.
El tiempo de relajación isovolumétrica (IVRT) es el tiempo entre el cierre de la
válvula aórtica y la apertura de la válvula mitral y está prolongado en feto y
recién nacido inmaduro. También se ha demostrado que disminuye en neonatos con
DAP significativo debido al cierre / apertura valvular temprana relacionado
con presión.38,39
Otros efectos potenciales de la carga de volumen / presión del corazón izquierdo incluyen regurgitación de válvula mitral y estiramiento del tabique interaurícular que aumenta el tamaño del defecto del tabique auricular.35 Un aumento en el flujo transauricular de izquierda a derecha puede causar relaciones reducidas LA: Ao y E: A y aumento del tiempo de relajación isovolumétrica por descarga de aurícula izquierda y alivio de carga presión / volumen. Esto puede explicar, en parte, el menor valor predictivo de estos parámetros en forma aislada y enfatiza aún más la necesidad de un enfoque más integral para documentar todas las posibles consecuencias e interacciones hemodinámicas.
4.2.2.- Hipoperfusión sistémica
El efecto del robo ductal en la perfusión sistémica también se puede cuantificar mediante ecocardiografía. La medición del flujo de vena cava superior (VCS) ha sido descrito recientemente y recomendado como marcador del flujo sanguíneo sistémico.16 El Hajjar et al. describieron un patrón similar en la circulación del cuerpo superior al comparar las proporciones relativas de flujo de LVO a VCS (LVO : VCS). El shunt transductal aumentado se asoció con una disminución proporcional del flujo de VCS , que es comparable al aumento de LVO, lo cual sugiere una circulación comprometida de la parte superior del cuerpo.36 Estos hallazgos son importantes dado que el bajo flujo de VCS se asocia con una mayor incidencia de hemorragia intraventricular tardía y puede ser un factor en la vía causal del deterioro del resultado del neurodesarrollo en pretérminos.17,18
Sin embargo, el flujo de VCS refleja el suministro de sangre al cerebro y la parte superior del cuerpo y, por lo tanto, no se puede obtener información sobre suministro de sangre a hígado, riñón e intestino. El uso de Doppler PW para evaluar el flujo a través de arteria mesentérica superior o arteria celíaca puede indicar el impacto del DAP sobre la perfusión intestinal. El flujo sanguíneo de arteria celíaca disminuye en presencia de DAP en comparación con los controles a pesar del aumento de LVO .40 Esta relación puede explicar la asociación entre DAP y enterocolitis necrosante. El flujo sanguíneo cerebral también puede verse afectado por la presencia de DAP. Los prematuros con DAP tienen velocidades de fin de diástole y de arteria cerebral media (ACM) y más bajas en presencia de DAP en comparación con los controles41. Se ha demostrado un aumento en MCA post ligadura de DAP en comparación con las mediciones preoperatorias.42 La relevancia clínica de este fenómeno no está clara. Sin embargo, puede ser un vínculo entre el desarrollo de DAP y hemorragia intraventricular.
Existen varios enfoques en el tratamiento de DAP en recién nacidos prematuros. Algunos autores defienden que la falta de evidencia sólida del beneficio del cierre del ductus niega la necesidad de tratar el DAP a menos que se produzca hipotensión intratable de insuficiencia cardíaca congestiva refractaria.43,44 Por el contrario, otros argumentan que el DAP siempre es patológico y, por lo tanto, debe tratarse siempre. La combinación de estos marcadores en una evaluación ecocardiográfica más completa puede proporcionar un método más preciso para seleccionar qué DAP justifica el tratamiento.
El sistema desarrollado por McNamara et al. sugiere la necesidad de considerar la heterogeneidad de la enfermedad ductal, ya que puede facilitar una mejor estratificación de los recién nacidos que pueden beneficiarse de intervención terapéutica de aquellos en los que el tratamiento puede no ofrecer ningún beneficio.45 Una pequeña evaluación prospectiva reciente proporciona alguna evidencia de que la clasificación puede ser útil; específicamente, los recién nacidos clasificados como teniendo un ductus arterioso de alto grado tienen mayor riesgo de morbilidad respiratoria.46 Se necesitan más estudios para validar un enfoque más integral de la evaluación ductal.
Finalmente, existe evidencia reciente de que la ecocardiografía seriada puede ser útil para guiar la duración de la administración de indometacina en prematuros < 30 semanas de edad gestacional.47 Después de la primera dosis de indometacina, los niños fueron asignados randomizadamente a un grupo de cuidado clínico de rutina en el que recibían un régimen terapéutico estándar (2 dosis adicionales de indometacina de 0.1 mg / kg) o un brazo guiado por ecocardiografía. En este último grupo, se realizó una ecocardiografía después de cada dosis de indometacina y se administraron dosis posteriores solo si el diámetro transductal era > 1,6 mm. Los recién nacidos randomizados al grupo de cuidado guiado por ecocardiografía recibieron menos dosis de indometacina [mediana, 1 dosis (rango: 1 a 15) versus 3 dosis (rango: 1 a 12); P < 0.0001]. No hubo diferencias en términos de falla del cierre del DAP, reapertura del CAP, necesidad de más dosis de indometacina o la necesidad de ligadura quirúrgica.47
4.3.- Evaluación de hemodinamia pulmonar
Los recién nacidos a término nacidos con
evidencia de hipoxemia en el período neonatal temprano plantean un desafío
diagnóstico. La hipertensión pulmonar persistente neonatal (HPPN) es
un diagnóstico generalmente realizado después de la confirmación
ecocardiográfica de la anatomía cardíaca normal. Aunque este examen inicial
idealmente debería ser realizado por un cardiólogo, la disponibilidad inmediata
de la prueba puede no ser factible. Mientras tanto, es posible que sea necesario
tomar decisiones críticas en términos de iniciar terapia apropiada (óxido
nítrico inhalado versus prostaglandinas), la decisión de trasaladar al bebé a un
centro adecuado y asesoramiento a los padres. Además, un largo examen
anatómico detallado en el período crítico inicial puede causar inestabilidad
clínica.
Un ecocardiograma funcional realizado para
descartar anormalidades anatómicas mayores y para establecer presiones
pulmonares sería ideal. De manera similar, los prematuros con
enfermedad pulmonar crónica y aumento de requerimientos de oxígeno pueden
tener resistencia vascular pulmonar elevada subclínica. Conocer las
presiones pulmonares en esta población puede ser beneficioso para instituir
estrategias de tratamiento.
La evaluación del recién nacido con hipertensión pulmonar puede dividirse en
Evaluación de la gravedad de la hipertensión pulmonar
Evaluación del impacto sobre el rendimiento del VD y hemodinamia pulmonar y
Evaluación del impacto sobre el rendimiento del VI y flujo sanguíneo sistémico.
4.3.1.- Evaluación de severidad de hipertensión pulmonar
La evaluación de la presión sistólica del ventrículo derecho (RVSP) es posible en presencia de regurgitación tricuspídea y se calcula utilizando la ecuación de Bernoulli :
RVSP = presión auricular derecha + (4 x Jet Regurgitación Tricúspide x V2 max ) donde Vmax = peak velocity.
Esta medida subestimará la severidad de la hipertensión pulmonar si hay deterioro de la contractilidad del VD.
La presencia de PDA también se puede utilizar para estimar las presiones pulmonares si se conocen presiones sistólicas sistémicas. La presión arterial pulmonar se puede estimar en presencia de un DAP con flujo no restrictivo. La velocidad máxima del flujo transductal se puede aplicar a la ecuación de Bernoulli para calcular la diferencia de presión entre las circulaciones sistémica y pulmonar (Figura 3).
La dirección del flujo transductal también se puede usar para evaluar la gravedad de la hipertensión
pulmonar. Se observa un shunt no restrictivo de derecha a izquierda con hipertensión pulmonar suprasistémica; mientras que un
shunt
bidireccional implica que las presiones de arteria pulmonar se aproximan a
las presiones sistémicas. El porcentaje de flujo de derecha a izquierda del
flujo transductal total también se puede calcular para documentar aún más la
gravedad de la hipertensión pulmonar.
En ausencia de estos shunts , la evaluación directa de la presión de la arteria pulmonar es difícil en los RN prematuros, particularmente en aquellos pacientes con enfermedad pulmonar crónica. La evaluación de la arteria pulmonar utilizando la relación del tiempo de eyección de arteria pulmonar al tiempo de eyección del ventrículo derecho (AT / RVET (C)), el cual puede estimarse de forma no invasiva a partir de formas de onda Doppler de arteria pulmonar , se correlaciona negativamente con las presiones de la arteria pulmonar en bebés prematuros.48 - 50 El tiempo de aceleración se mide como el intervalo de tiempo entre la línea de base de la señal Doppler y la velocidad máxima. RVET es el intervalo de tiempo de la fase de eyección del ventrículo derecho. El AT / RVET (c) se calcula dividiendo AT / RVET por la raíz cuadrada del intervalo R - R a partir de un trazado de un electrocardiograma simultáneo.
Varios estudios han demostrado que la hipertensión pulmonar precoz en recién nacidos prematuros, evaluada mediante AT / RVET, es un buen predictor de CLD de inicio tardío50. Conocer las presiones pulmonares en los recién nacidos con PPHN puede orientar las medidas terapéuticas de manejo y weaning. Además, la hemodinamia pulmonar se puede evaluar en neonatos con displasia broncopulmonar, con deterioro respiratorio agudo o un aumento crónico de los requerimientos de oxígeno. La documentación de la hipertensión pulmonar en estos bebés puede orientar las intervenciones terapéuticas, tales como óxido nítrico o sildenafil51.
4.3.2.- Evaluación de rendimiento ventricular derecho y hemodinamia pulmonar
En algunos pacientes, el impacto de la hipertensión pulmonar y el aumento de la poscarga del VD pueden incluir contractilidad del VD deteriorada. Aunque la disfunción sistólica del ventrículo derecho moderada a severa es obvia por inspección visual directa, no existe un marcador confiable o temprano de falla del VD. El bajo débito de VD (< 170 ml / min / kg) también puede apoyar un diagnóstico de deterioro del rendimiento del VD y también puede ser útil para documentar la respuesta a fármacos inodilatadores como Milrinona. Se ha demostrado que la evaluación no invasiva del débito del VD tiene un alto coeficiente de repetibilidad que se corresponde con los datos publicados sobre valores del lado izquierdo. La obtención de medidas objetivas de la contractilidad del VD mediante ecocardiografía convencional es difícil.
La complejidad de la anatomía del VD y el hecho de que esté "envuelto" alrededor del VI hace que la evaluación cuantitativa por M-modo sea inviable. Además, el movimiento de la pared septal ventricular suele estar dominado por el VI y, por lo tanto, FS es algo sin sentido. A pesar de estos inconvenientes, la evaluación subjetiva es posible utilizando vistas subcostales, apicales y paraesternal. En los bebés con HPPN el VD parece ser más grande y más rígido que el VI, con un tracto de salida dilatado. Además, la contractilidad puede aparecer disminuida subjetivamente. El tabique interventricular puede aplanarse debido a la presión creciente del VD. El movimiento de la pared septal puede revertirse en casos severos. Esto se denomina movimiento de pared paradójico. Es una observación importante que hacer ya que inutiliza los índices de la función del ventrículo izquierdo medidos por el modo m.
5.- Otras aplicacipnes potenciales
El rol ampliado de la ecografía de cabecera incluye el screening para HIV, la inserción y monitoreo de catéter umbilical o percutáneo, evaluación de los órganos intraabdominales,ej; tamaño de la vejiga o screening de ascitis u otros derrames de la cavidad. El rol de la ecografía de cabecera para facilitar la inserción y el monitoreo del catéter es particularmente importante. Con la ecocardiografía, la unión de aurícula derecha con vena cava inferior se puede visualizar fácilmente utilizando una visión subcostal parasagital. Esto puede facilitar la colocación en tiempo real de catéteres de vena umbilical (UVC), lo que minimiza la cantidad de radiografías tomadas y la manipulación del bebé. En un estudio de 53 recién nacidos, la ecocardiografía reveló que el 77% de los UVC considerados en buena posición por radiografías de tórax estaban incorrectamente posicionados.52 El rol del ultrasonido de cabecera en la colocación de línea de soporte en recién nacidos puede reducir el número de líneas colocadas incorrectamente y minimizar manipulación del niño.
El uso creciente de la ecocardiografía
funcional en UCIN ha conducido a una mayor tasa de detección de trombos
intravasculares asociados con catéteres de arteria umbilical.53,54 Sin
embargo, no hay consenso para guiar el manejo de este hallazgo incidental. Informes anecdóticos sugieren que la mayoría de estos trombos se resuelven
espontáneamente una vez que se extraen los catéteres. También se pueden detectar
vegetaciones intracardiacas en asociación con líneas largas y UVC en niños con
cultivos persistentemente positivos y trombocitopenia persistente. La opinión de
un cardiólogo pediátrico es muy recomendada para el manejo de estos
casos.55 El ultrasonido se ha utilizado recientemente para evaluar
enterocolitis necrosante (ECN).
Evidencia reciente muestra que la ecografía
supera a la radiografía simple de abdomen en la representación del líquido intraabdominal, el grosor de la pared intestinal, la perfusión de pared
intestinal y la detección de necrosis intestinal.56 Se ha demostrado que la
ecografía predice resultados adversos en neonatos con NEC. La identificación de
gas libre, colecciones de líquidos focales, aumento de la ecogenicidad
intestinal y ausencia de perfusión intestinal se asociaron particularmente con
la mortalidad.57 Además, se ha demostrado que el ultrasonido detecta el
intestino gravemente isquémico o necrótico cuando las radiografías simples de
abdomen no son concluyentes.58 Esto tiene el potencial de agilizar la
intervención quirúrgica antes de que ocurra la perforación.
6.- Impacto de ecocardiografía funcional realizada por neonatólogo sobre outcomes neonatales
La disponibilidad de ecocardiografía
funcional en la unidad neonatal puede influir en el tratamiento y el resultado a
corto plazo. En una revisión retrospectiva de 241 neonatos ingresados en una
UCIN terciaria, la ecocardiografía realizada por neonatólogos bajo la
supervisión de cardiólogos se asoció con un cambio directo de manejo en 66% de
los recién nacidos examinados.59 Los diagnósticos incluyeron cardiopatía
estructural (33%), DAP hemodinámicamente significativo (3%), HPPN (6%) y
disfunción del VI (3%). En otro estudio retrospectivo, se comparó el efecto de
la ecocardiografía seriada realizada por un neonatólogo y el tratamiento
médico de DAP precoz con los controles históricos. La ecocardiografía seriada se
asoció con identificación y tratamiento de DAP más temprano, tasas más
bajas de HIV grave (de 36 a 10%, P = 0.046) y días de ventilación reducidos (de
13 a 9 días, P = 0.036) .6 Futuros esudios controlados randomizados de ecocardiografía
seriada y tratamiento precoz del DAP son deseables.
7.- Estándar para práctica
Existe una creciente aceptación de que la ecocardiografía funcional realizada por neonatólogo es una herramienta útil en UCIN, con una evidencia creciente de mejores resultados en los pacientes. Lo que falta en este momento es un programa formalizado de formación y acreditación necesario para el desarrollo de las habilidades de ecocardiografía.60 Los riesgos potenciales de introducir este conjunto de habilidades sin entrenamiento formal incluyen una divergencia con las evaluaciones clínicas y el diagnóstico erróneo de cardiopatía congénita (CHD). Esto puede ocasionar la mantención inadvertida de tratamientos o la implementación de terapias incorrectas. La colaboración con el servicio de cardiología pediátrica es esencial para desarrollar estándares para la práctica. Es esencial que se establezcan estándares para garantizar que la competencia se logre y se mantenga con un aseguramiento continuo de la calidad. La principal preocupación de los neonatólogos con respecto al uso de ultrasonido funcional es la posibilidad de un diagnóstico erróneo.
Aunque es importante reconocer que los
neonatólogos pueden pasar por alto la CHD, la presencia de una anomalía cardíaca
estructural casi siempre se detecta, incluso si no se realiza un diagnóstico
completo.9 Los estudios realizados por neonatólogos tienen un propósito
diferente, como se mencionó anteriormente. en esta revisión, y debe complementar
los realizados por los cardiólogos. Cualquier anomalía detectada o sospechada
debe ser confirmada por un cardiólogo pediátrico entrenado. La demanda de
ultrasonido funcional realizado por un neonatólogo está aumentando.
Existen numerosos médicos en todo el mundo que utilizan ecocardiografía funcional de cabecera sin entrenamiento formal. Existe una necesidad urgente de desarrollar programas estandarizados de capacitación y acreditación para evitar el uso indebido potencial de esta habilidad. Dichos programas formales de capacitación son insuficientes. Esto resalta la necesidad de colaboración con los cardiólogos pediátricos en el desarrollo de estos programas ya que poseen las habilidades necesarias. Los programas formales de capacitación deben incluir el uso de DVD disponibles, libros y conferencias didácticas. El conocimiento de habilidades prácticas, equipos de ultrasonido y modalidades disponibles también forman parte del conjunto de habilidades prácticas.
También se debe poner énfasis en reconocer las limitaciones y saber cuándo llamar al personal más experimentado. Esto debe ser realizados por neonatólogos experimentados y cardiólogos pediátricos interesados. La educación y la auditoría continuas deben ser parte integral de cualquier programa de capacitación.5 Una vez que se adquiere el conjunto de habilidades, se deben abordar los desafíos logísticos. Estos incluyen acceso a equipos, reportes de estudio, archivo y almacenamiento. Actualmente, la mayoría de los estudios realizados por neonatólogos no se almacenan a largo plazo y se informan a mano. Claramente, este no es un sistema que pueda sostenerse.
8.- Conclusión
El rol ampliado de la ecocardiografía funcional realizada por un neonatólogo está ganando impulso. Existe una creciente evidencia de que puede proporcionar una evaluación más completa del estado hemodinámico de los bebés y puede influir en el tratamiento. Existe una necesidad urgente de alentar la colaboración con los cardiólogos pediátricos para establecer normas para la capacitación y el mantenimiento de la competencia, desarrollar guías de práctica clínica y finalmente garantizar que exista la la organización clínica necesaria para identificar claramente los roles complementarios del neonatólogo y el pediatra cardiólogo en este proceso.
P
untos prácticos
El examen por ultrasonido de cabecera facilita la provisión de información fisiológica importante en tiempo real para guiar el diagnóstico y la intervención terapéutica.
La evaluación ecocardiográfica del recién nacido se complica por cuestiones relacionadas con el tamaño del paciente y las ventanas acústicas transtorácicas.
El conocimiento básico de las diferentes modalidades ecocardiográficas, incluido el Doppler, es esencial para una evaluación completa de la función.
La ecocardiografía funcional realizada por un neonatólogo se utiliza para evaluar y delinear la naturaleza de la inestabilidad hemodinámica, la significancia de un DAP y la presencia o gravedad de la hipertensión pulmonar.
El papel de la ecocardiografía funcional puede ampliarse para evaluar la colocación de línea central y la presencia de vegetaciones.
Existe una necesidad urgente de programas formales de capacitación y acreditación en la ecocardiografía funcional realizada por un neonatólogo.
La colaboración con los cardiólogos pediátricos es esencial para la capacitación inicial, el mantenimiento de las habilidades y el apoyo continuo.
Direcciones de la investigación
Evaluar el rol del ultrasonido de cabecera sobre el impacto del resultado en recién nacidos prematuros.
Faltan datos normativos para muchos parámetros de ecocardiografía.
Técnicas avanzadas de ecocardiografía, ej; Doppler tisular e imagenología de presión ventricular en la población neonatal.
Uso de la ecocardiografía funcional para determinar el agente cardiotrópico más apropiado para el tratamiento del compromiso hemodinámico.
Referencias
Osborn DA, Evans N, Kluckow M. Clinical detection of low upper body blood flow in very premature infants using blood pressure, capillary refill time, and centraleperipheral temperature difference. Arch Dis Child Fetal Neonatal Ed 2004;89:F168e73.
Beaulieu Y. Bedside echocardiography in the assessment of the critically ill. Crit Care Med 2007;35(5 Suppl.):S235e49.
Marcelino PA, Marum SM, Fernandes AP, Germano N, Lopes MG. Routine transthoracic echocardiography in a general intensive care unit: an 18 month survey in 704 patients. Eur J Intern Med 2009;20:e37e42.
Evans JR, Lou SB, Van MK, Cheryl SH. Cardiovascular support in preterm infants. Clin Ther 2006;28:1366e84.
Sehgal A, McNamara PJ. Does point-of-care functional echocardiography enhance cardiovascular care in the NICU? J Perinatol 2008;28:729e35.
O’Rourke DJ, El-Khuffash A, Moody C, Walsh K, Molloy EJ. Patent ductus arteriosus evaluation by serial echocardiography in preterm infants. Acta Paediatr 2008;97:574e8.
Lee HC, Silverman N, Hintz SR. Diagnosis of patent ductus arteriosus by a neonatologist with a compact, portable ultrasound machine. J Perinatol 2007;27:291e6.
Moss S, Kitchiner DJ, Yoxall CW, Subhedar NV. Evaluation of echocardiography on the neonatal unit. Arch Dis Child Fetal Neonatal Ed 2003;88:F287e9.
Samson GR, Kumar SR. A study of congenital cardiac disease in a neonatal population e the validity of echocardiography undertaken by a neonatologist. Cardiol Young 2004;14:585e93.
Evans N, Archer N. Non-invasive assessment of pulmonary arterial pressure in healthy neonates. Arch Dis Child 1992;67(4 Special No.):471.
Al-Aweel I, Pursley DM, Rubin LP, Shah B, Weisberger S, Richardson DK. Variations in prevalence of hypotension, hypertension, and vasopressor use in NICUs. J Perinatol 2001;21:272e8.
Kluckow M, Evans N. Relationship between blood pressure and cardiac output in preterm infants requiring mechanical ventilation. J Pediatr 1996;129: 506e12.
Kluckow M, Evans N. Low superior vena cava flow and intraventricular haemorrhage in preterm infants. Arch Dis Child Fetal Neonatal Ed 2000;82:F188e94.
Evans N, Kluckow M. Early determinants of right and left ventricular output in ventilated preterm infants. Arch Dis Child Fetal Neonatal Ed 1996;74:F88e94.
Sahni M, Sehgal A, Stewart L, Shivananda S, McNamara PJ. Early functional echocardiography (fECHO) predicts postoperative cardiorespiratory instability after patent ductus arteriosus (PDA) ligation. E-PAS; 2009. 2740.5. 3-5-2009.
Kluckow M, Evans N. Superior vena cava flowin newborn infants: a novel marker of systemic blood flow. Arch Dis Child Fetal Neonatal Ed 2000;82:F182e7.
Osborn DA, Evans N, Kluckow M. Hemodynamic and antecedent risk factors of early and late periventricular/intraventricular hemorrhage in premature infants. Pediatrics 2003;112(1 Pt 1):33e9.
Hunt RW, Evans N, Rieger I, Kluckow M. Low superior vena cava flow and neurodevelopment at 3 years in very preterm infants. J Pediatr 2004;145:588e92.
Greisen G. Autoregulation of cerebral blood flow in newborn babies. Early Hum Dev 2005;81:423e8.
Groves AM, Kuschel CA, Knight DB, Skinner JR. Echocardiographic assessment of blood flow volume in the superior vena cava and descending aorta in the newborn infant. Arch Dis Child Fetal Neonatal Ed 2008;93:F24e8.
Rowland DG, Gutgesell HP. Noninvasive assessment of myocardial contractility, preload, and afterload in healthy newborn infants. Am J Cardiol 1995;75:818e21.
Gill AB, Weindling AM. Echocardiographic assessment of cardiac function in shocked very low birthweight infants. Arch Dis Child 1993;68(1 Special No.):17e21.
Osborn DA, Evans N, Kluckow M. Left ventricular contractility in extremely premature infants in the first day and response to inotropes. Pediatr Res 2007;61:335e40.
Colan SD, Borow KM, Neumann A. Left ventricular end-systolic wall stressvelocity of fiber shortening relation: a load-independent index of myocardial contractility. J Am Coll Cardiol 1984;4:715e24.
El-Khuffash A, Davis PG, Walsh K, Molloy EJ. Cardiac troponin T and Nterminal- pro-B type natriuretic peptide reflect myocardial function in preterm infants. J Perinatol 2008;28:482e6.
Harada K, Shiota T, Takahashi Y, Tamura M, Toyono M, Takada G. Doppler echocardiographic evaluation of left ventricular output and left ventricular diastolic filling changes in the first day of life. Pediatr Res 1994;35(4 Pt 1):506e9.
Tham EB, Silverman NH. Measurement of the Tei index: a comparison of M-mode and pulse Doppler methods. J Am Soc Echocardiogr 2004;17: 1259e65.
Harada K, Tamura M, Toyono M, Yasuoka K. Comparison of the right ventricular Tei index by tissue Doppler imaging to that obtained by pulsed Doppler in children without heart disease. Am J Cardiol 2002;90:566e9.
Harjai KJ, Scott L, Vivekananthan K, Nunez E, Edupuganti R. The Tei index: a new prognostic index for patients with symptomatic heart failure. J Am Soc Echocardiogr 2002;15:864e8.
Skelton R, Evans N, Smythe J. A blinded comparison of clinical and echocardiographic evaluation of the preterm infant for patent ductus arteriosus. J Paediatr Child Health 1994;30:406e11.
Alagarsamy S, Chhabra M, Gudavalli M, Nadroo AM, Sutija VG, Yugrakh D. Comparison of clinical criteria with echocardiographic findings in diagnosing PDA in preterm infants. J Perinat Med 2005;33:161e4.
Evans N. Diagnosis of patent ductus arteriosus in the preterm newborn. Arch Dis Child 1993;68(1 Special No.):58e61.
Kupferschmid C, Lang D, Pohlandt F. Sensitivity, specificity and predictive value of clinical findings, m-mode echocardiography and continuous-wave Doppler sonography in the diagnosis of symptomatic patent ductus arteriosus in preterm infants. Eur J Pediatr 1988;147:279e82.
Kluckow M, Evans N. Early echocardiographic prediction of symptomatic patent ductus arteriosus in preterm infants undergoing mechanical ventilation. J Pediatr 1995;127:774e9.
Iyer P, Evans N. Re-evaluation of the left atrial to aortic root ratio as a marker of patent ductus arteriosus. Arch Dis Child Fetal Neonatal Ed 1994;70:F112e7.
El HM, Vaksmann G, Rakza T, Kongolo G, Storme L. Severity of the ductal shunt: a comparison of different markers. Arch Dis Child Fetal Neonatal Ed 2005;90:F419e22.
Suzumura H, Nitta A, Tanaka G, Arisaka O. Diastolic flow velocity of the left pulmonary artery of patent ductus arteriosus in preterm infants. Pediatr Int 2001;43:146e51.
Schmitz L, Stiller B, Koch H, Koehne P, Lange P. Diastolic left ventricular function in preterm infants with a patent ductus arteriosus: a serial Doppler echocardiography study. Early Hum Dev 2004;76:91e100.
Schmitz L, Stiller B, Pees C, Koch H, Xanthopoulos A, Lange P. Doppler-derived parameters of diastolic left ventricular function in preterm infants with a birth weight <1500 g: reference values and differences to term infants. Early Hum Dev 2004;76:101e14.
El-Khuffash A, Higgins M, Walsh K, Molloy EJ. Quantitative assessment of the degree of ductal steal using celiac artery blood flow to left ventricular output ratio in preterm infants. Neonatology 2008;93:206e12.
Weir FJ, Ohlsson A, Myhr TL, Fong K, Ryan ML. A patent ductus arteriosus is associated with reduced middle cerebral artery blood flow velocity. Eur J Pediatr 1999;158:484e7.
Hoodbhoy SA, Cutting HA, Seddon JA, Campbell ME. Cerebral and splanchnic hemodynamics after duct ligation in very low birth weight infants. J Pediatr 2009;154:196e200.
Bose CL, Laughon MM. Patent ductus arteriosus: lack of evidence for common treatments. Arch Dis Child Fetal Neonatal Ed 2007;92:F498e502.
Raval MV, Laughon MM, Bose CL, Phillips JD. Patent ductus arteriosus ligation in premature infants: who really benefits, and at what cost? J Pediatr Surg 2007;42:69e75.
McNamara PJ, Sehgal A. Towards rational management of the patent ductus arteriosus: the need for disease staging. Arch Dis Child Fetal Neonatal Ed 2007;92:F424e7.
Naik-Mathuria B, Chang S, Fitch ME, et al. Patent ductus arteriosus ligation in neonates: preoperative predictors of poor postoperative outcomes. J Pediatr Surg 2008;43:1100e5.
Carmo KB, Evans N, Paradisis M. Duration of indomethacin treatment of the preterm patent ductus arteriosus as directed by echocardiograph y. J Pediatr 2009;155:819e22.
Murase M, Ishida A. Serial pulsed Doppler assessment of pulmonary artery pressure in very low birth-weight infants. Pediatr Cardiol 2000; 21:452e7.
Gill AB, Weindling AM. Pulmonary artery pressure changes in the very low birthweight infant developing chronic lung disease. Arch Dis Child 1993;68(3 Special No.):303e7.
Subhedar NV, Hamdan AH, Ryan SW, Shaw NJ. Pulmonary artery pressure: early predictor of chronic lung disease in preterm infants. Arch Dis Child Fetal Neonatal Ed 1998;78:F20e4.
Mourani PM, Sontag MK, Ivy DD, Abman SH. Effects of long-term sildenafil treatment for pulmonary hypertension in infants with chronic lung disease. J Pediatr 2009;154:379e84.
Ades A, Sable C, Cummings S, Cross R, Markle B, Martin G. Echocardiographic evaluation of umbilical venous catheter placement. J Perinatol 2003;23:24e8.
Deeg KH, Wolfel D, Rupprecht T. Diagnosis of neonatal aortic thrombosis by colour coded Doppler sonography. Pediatr Radiol 1992;22:62e3.
Roy M, Turner-Gomes S, Gill G, Way C, Mernagh J, Schmidt B. Accuracy of Doppler echocardiography for the diagnosis of thrombosis associated with umbilical venous catheters. J Pediatr 2002;140:131e4.
El-Khuffash AF, Molloy EJ, Walsh K. Left atrial appendage mimicking an intracardiac vegetation in preterm neonates. Neonatology 2008;93:113e6.
Faingold R, Daneman A, Tomlinson G, et al. Necrotizing enterocolitis: assessment of bowel viability with color doppler US. Radiology 2005;235:587e94.
Silva CT, Daneman A, Navarro OM, et al. Correlation of sonographic findings and outcome in necrotizing enterocolitis. Pediatr Radiol 2007;37:274e82.
Epelman M, Daneman A, Navarro OM, et al. Necrotizing enterocolitis: review of state-of-the e art imaging findings with pathologic correlation. Radiographics 2007;27:285e305.
Kadivar M, Kiani A, Kocharian A, Shabanian R, Nasehi L, Ghajarzadeh M. Echocardiography and management of sick neonates in the intensive care unit. Congenit Heart Dis 2008;3:325e9.
Kluckow M, Seri I, Evans N. Functional echocardiography: an emerging clinical tool for the neonatologist. J Pediatr 2007;150:125e30.