Ductus Arterioso persistentePagina Modelo
Agosto 2018
Diagnosis and Management of Patent
Ductus Arteriosus
Maria Gillam-Krakauer
Neoreviews Julio 2018
Traducción Interna Andrea Aránguiz
INTRODUCCIÓN
El
ductus arterioso es una derivación vascular central que conecta la arteria pulmonar con la aorta, permitiendo que la sangre oxigenada de la placenta pase por alto los pulmones fetales no inflados y entre en la circulación sistémica. El cierre rápido del conducto arterioso después del nacimiento es esencial para la transición vascular al patrón maduro y dividido de la circulación arteriovenosa. El fracaso del cierre del ductus arterioso, denominado ductus arterioso persistente (DAP), es principalmente una afección del prematuro, y el ductus permanece abierto a los 7 días de edad en hasta el 64% de los R. Nacidos entre las 27 y las 28 semanas de gestación y el 87% de R. Nacidos a las 24 semanas. Ha habido un cambio en la presentación y el tratamiento de los neonatos con DAP en los últimos 30 años. Antes del uso de corticosteroides prenatales, el DAP se encontraba con frecuencia en prematuros de todas las edades gestacionales y estaba asociada con el síndrome de dificultad respiratoria. El tratamiento con indometacina fue estándar, y los estudios evaluaron los beneficios de la ligadura de DAP temprana (o incluso profiláctica).
Con los avances en las estrategias de ventilación, el uso de corticosteroides prenatales y el surfactante exógeno, y una mayor disposición a esperar el cierre espontáneo del ductus arterioso, los prematuros más maduros en la actualidad rara vez requieren intervención para un ductus arteriosus. (5) En cambio, el manejo del DAP ahora se centra en los neonatos más prematuros, en los que el ductus puede ser resistente al tratamiento farmacológico. Esta revisión analiza las indicaciones en evolución para el tratamiento de un DAP y las diversas opciones de tratamiento disponibles.
FACTORES DE RIESGO
La incidencia de DAP se asocia inversamente con el grado de prematuridad. Otros factores asociados con un mayor riesgo de DAP en el prematuro incluyen síndrome de dificultad respiratoria, alto volumen de líquidos intravenosos (> 170 ml / kg por día) en la primera semana, sepsis, ruptura prolongada de membranas, furosemida, sexo masculino y otros contribuyentes. La evidencia también muestra que los antibióticos aminoglucósidos y ciertos antiácidos, que se usan con frecuencia en los recién nacidos, aumentan paradójicamente el riesgo de DAP . Los corticosteroides prenatales y la hipertensión materna disminuyen la incidencia de DAP. E l efecto de los corticosteroides prenatales en el cierre del conducto arterioso es independiente de su efecto sobre la maduración pulmonar, y es más beneficioso cuando se administran corticosteroides al menos 24 horas antes del parto. El surfactante exógeno no afecta directamente el ductus arterioso, pero puede desenmascarar un ductus permeable al disminuir la resistencia vascular pulmonar y, por lo tanto, permitir un aumento de la derivación de izquierda a derecha.
DIAGNÓSTICO
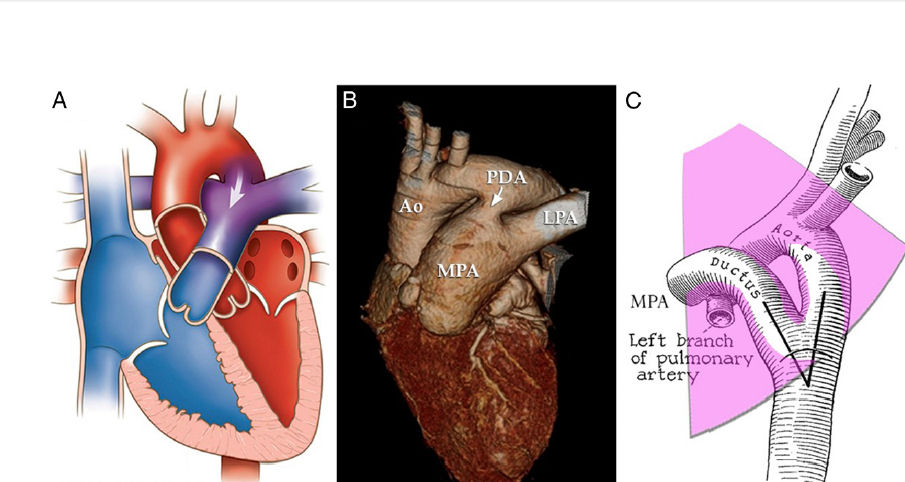
Falta una definición de consenso para DAP hemodinámicamente significativo El diagnóstico a menudo se sospecha clínicamente, cuando un neonato muestra signos de derivación excesiva de la circulación arterial a la pulmonar (Fiura 1A y 1B):
Soplo continuo o sistólico; nota, un DAP "silencioso" también puede ocurrir cuando la derivación del conducto es lo suficientemente grande como para que el flujo no turbulento no genere un soplo detectable.
Presión arterial diastólica baja (debido a runoff hacia ductus durante la diástole, más frecuente en los bebés más prematuros)
Una presión de pulso amplia (debido a runoff o robo del ductus)
Hipotensión (especialmente en los neonatos más prematuros)
Pulsos saltones
Aumento de concentración sérica de creatinina u oliguria.
Hepatomegalia


Figura. Evaluación del ductus arterioso permeable (DAP) con ecocardiografía.
A, B. - Derivación de izquierda a derecha (L-R) (indicada por flechas) a través del conducto produce la mayoría de los signos físicos y las complicaciones relacionadas con DAP.
C – E.- Vistas de eje corto y supraesternales revelan relaciones estructurales y patrones de flujo Doppler color indicativos de shunt L-R a través del conducto arterioso. Ao = aorta; Arteria pulmonar izquierda = LPA; MPA = Arteria pulmonar principal .
A menudo se observan signos de edema pulmonar, como taquipnea, disminución de la saturación de oxígeno y aumento del soporte respiratorio. La radiografía de tórax puede mostrar estigmas de edema pulmonar. El gasto cardíaco neonatal puede aumentar hasta un 25% en un esfuerzo por superar el robo del conducto.
La sospecha clínica debe confirmarse con ecocardiografía (tabla 1). El tamaño del ductus solo no es adecuado para atribuir importancia hemodinámica. Aunque un diámetro transductor absoluto de más de 1.5 a 1.7 mm por Doppler color (Fig. 1C y 1D) se ha asociado con una mayor propensión a la hipoperfusión, el diámetro exacto en el que ocurrirá compromiso hemodinámico significativo varía según el paciente y la edad postnatal, dependiendo del tamaño del cuerpo y muchos otros factores, que incluyen saturación de oxígeno, administración de surfactante y furosemida. El Hajjar et al sugieren que al normalizar el peso corporal, una medida más sensible es un diámetro del conducto mayor o igual a 1,4 mm / kg. Una gran derivación de izquierda a derecha sugiere una derivación hemodinámicamente significativa. Sin embargo, el grado de shunt depende en gran parte de la resistencia vascular pulmonar. Un ductus grande puede no mostrar un gran flujo de izquierda a derecha si se aumenta la resistencia vascular pulmonar. En contraste, una derivación de derecha a izquierda puede indicar una hipertensión pulmonar significativa; el cierre agudo del conducto en este escenario no está indicado, ya que podría empeorar la insuficiencia cardíaca derecha. Con una gran derivación de izquierda a derecha, a menudo se pueden observar signos indirectos de hipertensión pulmonar obligatoria; Esto generalmente no es una contraindicación para el cierre del conducto, sino más bien una consecuencia natural del flujo sanguíneo pulmonar excesivo.
Tabla 1
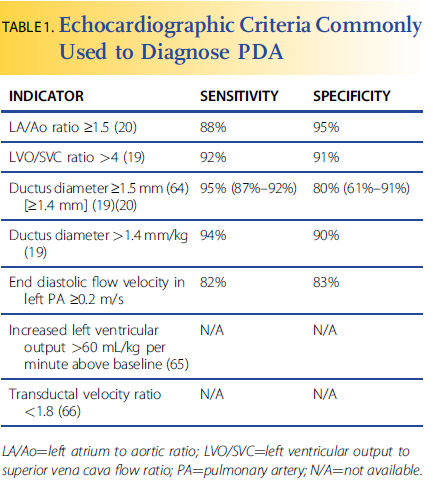
Otros criterios ecocardiográficos utilizados para determinar la significancia hemodinámica son la presencia de reversión del flujo hacia adelante en la aorta descendente durante la diástole (que indica una derivación a través del DAP ), y la dilatación auricular o ventricular izquierda, que son la consecuencia de la sobrecirculación del lecho vascular pulmonar y un estado hiperdinámico crónico.
El flujo de izquierda a derecha a través del tabique intraauricular es indicativo de una gran derivación. La relación entre la salida del ventrículo izquierdo y el flujo de la vena cava superior es directamente proporcional al flujo del conducto y, cuando es mayor o igual a 4, puede indicar una importancia hemodinámica.
Una proporción de la aurícula izquierda a raíz aórtica (LA / Ao) es más sensible cuando se realiza después del día 1, y se considera anormal si es mayor que 1.5. A modo de comparación, el
ductus se considera ampliamente persistente cuando la relación LA / Ao es mayor que 1.6 y se cierra cuando la relación es 1.17. Si se usa un valor de corte de 1.4, la sensibilidad de la relación LA / Ao cae de 88% a entre 50% y 79%.
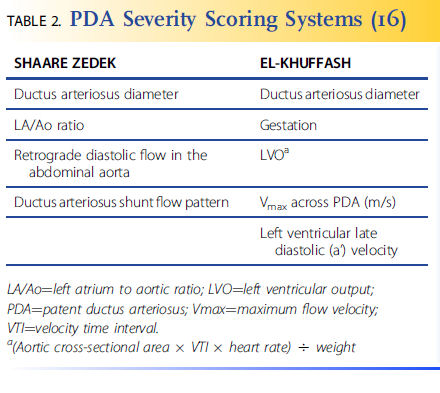
Se han desarrollado
scores de gravedad de DAP que combinan varios factores y se pueden usar para predecir una mayor probabilidad de resultados graves, como muerte / enfermedad pulmonar crónica (EPC), leucomalacia periventricular o enterocolitis necrotizante (ECN). El beneficio de un sistema de puntuación es que enfatiza la importancia de examinar múltiples factores al determinar cuándo y cuándo intervenir por DAP .
La tabla 2 muestra una comparación de 2 sistemas de puntuación separados. Aunque utilizan diferentes factores, son equivalentes a la hora de definir un DAP hemodinámicamente significativo y una predicción de EPC o muerte. La puntuación de El-Khuffash se correlaciona significativamente con la ECN y la puntuación de Shaare Zedek se correlaciona significativamente con la leucomalacia periventricular.
Tabla 2
Biomarcadores
La prohormona terminal N (amino) del péptido natriurético de tipo B (NT-proBNP) y el péptido natriurético de tipo B maduro (BNP) pueden ser útil para detectar un DAP hemodinámicamente significativo. El miocardio ventricular secreta y libera el BNP cuando está bajo estrés debido a un aumento de volumen o presión.
El NT-proBNP, el BNP y la troponina cardíaca aumentan con el aumento de los marcadores ecocardiográficos de DAP y disminuyen después del cierre del ductus.
No se han realizado suficientes estudios para recomendar estos biomarcadores para uso rutinario en el manejo clínico de un PDA. Es probable que sean de mayor beneficio cuando se confirme el diagnóstico de DAP con ecocardiografía, pero no se dispone de ecocardiografía en serie para determinar la importancia hemodinámica, o para acortar el tratamiento farmacológico para un conducto. Shin et al suspendieron el tratamiento con ibuprofeno en neonatos con DAP cuando la concentración de BNP se redujo a menos de 600 pg / ml, lo que dio como resultado menos dosis de ibuprofeno en el grupo cuyo tratamiento se adaptó según BNP.
Biosensores
También se han desarrollado técnicas de bioingeniería y analíticas para monitorear o detectar DAP en prematuros. Varios enfoques incluyen la interpretación de la información de la oximetría de pulso (índice de perfusión, pletismografía), interpretación de señales eléctricas transtorácicas (impedancia, cardiometría, velocimetría, biorreactancia), oxigenación regional (espectroscopia de infrarrojo cercano), alteraciones en la microcirculación de la piel (imágenes de campo oscuro en la corriente lateral, espectrofotometría de reflectancia), espectroscopia Raman de resonancia (Lauren J. Ruoss, comunicación personal, mayo de 2018) y otros.
OUTCOMES
En neonatos sanos a término, el ductus arterioso se cierra en un plazo de 48 a 72 horas. En prematuros nacidos con más de 1,000 g, el conducto se cierra espontáneamente en el 67% del día 7 y en el 94% al alta. En general, solo el 3% de los bebés que pesan más de 1,000 g pueden requerir intervención para un DAP.
Sin embargo, en neonatos extremadamente prematuros que pesan menos de 1,000 g al nacer (peso extremadamente bajo al nacer), 57% a 69% todavía tendrán un DAP entre 7 y 10 días de edad. De los que cierran, hasta el 30% se reabrirá y luego podrá volver a cerrarse, o volverá a ser hemodinámicamente significativo y requerirá un cierre farmacológico o quirúrgico. Cuando no se trata, el tiempo medio para el cierre del conducto en esta población es de 56 días. Algunos bebés se someten a un cierre espontáneo del conducto hasta los 24 meses de edad. Aunque estos bebés solo representan una pequeña proporción de bebés prematuros y tienen PDA pequeños en el momento del alta hospitalaria, el reconocimiento de que el cierre de la PDA ocurre tarde en algunos casos ha llevado a algunos investigadores a suspender completamente el retratamiento. Debido a que DAP hemodinámicamente significativo se ha asociado con hemorragia intraventricular (HIV), hemorragia pulmonar, ECN, EPC y muerte, se requieren estudios más sustanciales antes de que se puedan adoptar ampliamente los enfoques de no intervención.
TRATAMIENTO
Algunos médicos eligen un enfoque profiláctico para el tratamiento con indometacina, con el objetivo de prevenir la IVH, la PDA y las consecuencias adversas que se han asociado con DAP en neonatos con peso extremadamente bajo al nacer. A pesar de la reducción exitosa en los resultados a corto plazo (IVH, hemorragia pulmonar, hipotensión, DAP sintomático, necesidad de ligadura), los beneficios a largo plazo son inciertos y los bebés pueden estar expuestos innecesariamente a un agente potencialmente dañino. Por otro lado, las UCIN con un uso consistente y de alto nivel de una estrategia profiláctica o un enfoque selectivo guiado por ecocardiografía para el tratamiento profiláctico pueden tener mejores resultados o una menor exposición al fármaco. Se necesitan estudios bien diseñados para aclarar los riesgos / beneficios de este enfoque.
Las indicaciones para el tratamiento de DAP sintomático incluyen compromiso respiratorio (por ejemplo, que requiere soporte mecánico persistente), insuficiencia cardíaca o derivación grande del conducto de izquierda a derecha con evidencia de compromiso hemodinámico, como la reversión del flujo en la aorta descendente durante la diástole, oliguria o aumento de la concentración sérica de creatinina, hipotensión o presión amplia del pulso.
En pacientes con más de 1,000 g de peso al nacer con pocos factores de riesgo, un PDA generalmente puede manejarse con éxito de manera conservadora, con una modesta restricción de líquidos y Uso de la presión espiratoria final positiva para tratar el edema pulmonar. Ciertos diuréticos, como la furosemida, pueden evitar que un conducto se cierre y no se recomiendan en las primeras 1 a 3 semanas, cuando la mayor disminución en el diámetro del conducto se produce de manera espontánea. Las medidas conservadoras también incluyen evitar otros medicamentos que promueven la relajación del conducto arterioso y el uso proactivo de agentes como la cafeína que se asocian con tasas más bajas de APD.
En pacientes con mayor riesgo de APD, o que pesen menos de 1,000 g al nacer, se recomienda un tratamiento conservador antes de comenzar el tratamiento farmacológico. Generalmente, el tratamiento no es necesario en los primeros días después del nacimiento, cuando la resistencia vascular pulmonar aún es elevada. Sin embargo, durante la segunda semana, debe considerarse el tratamiento si las medidas conservadoras no han logrado controlar el edema pulmonar o si hay insuficiencia cardíaca o renal. Después de la semana 3, es menos probable que las medidas farmacológicas tengan éxito.
El uso temprano de indometacina para cerrar un PDA poco después del nacimiento (día 1 a 2 de edad), en comparación con la espera de 3 a 4 días después del diagnóstico, disminuye el riesgo de hemorragia pulmonar e HIV, y la necesidad de ligadura. Aunque la PDA está asociada con la EPC, existe evidencia limitada que sugiere que el cierre farmacológico temprano mejora la incidencia de la EPC. El cierre farmacológico se asocia con una disminución del edema pulmonar y una mejor alveolarización (en los babuinos prematuros). Esto puede deberse, al menos en parte, a un efecto directo en el pulmón. El uso de ibuprofeno o indometacina se asocia con un aumento de los canales de sodio epitelial alveolar sensible a la amilorida, un mayor aclaramiento del agua pulmonar y un mejor cumplimiento pulmonar.
FARMACOLOGÍA
Tabla 3.- Dosis de fármacos para tratamiento de DAP

Hay 3 tratamientos farmacológicos disponibles para inducir la constricción de un DAP : indometacina, ibuprofeno y paracetamol (Tabla 3). La indometacina y el ibuprofeno son medicamentos antiinflamatorios no esteroideos clásicos (AINE), que inhiben de forma no selectiva las enzimas ciclooxigenasa, evitando la conversión del ácido araquidónico en prostaglandinas, que desempeñan un papel central en el mantenimiento de la permeabilidad del conducto. Desde 1976, la indometacina se ha utilizado para tratar DAP en bebés prematuros. Casi al mismo tiempo, el ibuprofeno se mostró en modelos de cordero para efectuar el cierre del conducto, pero no se usó ampliamente en bebés humanos hasta mediados de los años noventa. El acetaminofeno reduce la síntesis de prostaglandinas en un modo de acción diferente al de la mayoría de los AINE. Los ensayos clínicos aleatorizados recientes confirman su eficacia para el cierre de DAP , aunque la aprobación de la FDA para esta indicación está pendiente.
La indometacina se administra por vía intravenosa. Las preparaciones enterales y rectales no se recomiendan en bebés debido a un mayor riesgo de sangrado gastrointestinal.
En los pacientes que reciben un segundo ciclo de indometaminina, solo la mitad experimentará el cierre del conducto. Las probabilidades de no responder al segundo curso de indometacina aumentan en un 90% si no hubo respuesta al primer curso. La edad gestacional avanzada parece predecir la no respuesta a la indometacina.
Cuando se estudia de forma directa, la indometacina y el ibuprofeno tienen una eficacia similar (70%) para un curso inicial de 3 dosis. Independientemente del tratamiento, hay una tasa de reapertura de aproximadamente el 25%, especialmente en los bebés más prematuros. Debido a esta alta tasa de reapertura, algunos recomiendan una cuarta dosis de indometacina, administrada 24 horas después de la tercera dosis.
Se especula que el paracetamol disminuye la síntesis de prostaglandinas al interrumpir la síntesis de prostaglandinas en el sitio de la peroxidasa de la prostaglandina H2 sintetasa (ciclooxigenasa). El acetaminofeno para el tratamiento de la PDA se asocia con una menor elevación de la concentración sérica de creatinina y oliguria en comparación con el ibuprofeno o la indometacina, y una menor elevación de la bilirrubina en comparación con el ibuprofeno. El acetaminofeno se ha usado para terapia de rescate después de una respuesta fallida a la indometacina en bebés extremadamente prematuros, lo que resultó en que el 46% de los bebés tienen un conducto más pequeño o cerrado. Cuando se usa como tratamiento primario, la eficacia varía de 70% a 81%. La eficacia parece verse afectada tanto por la edad gestacional como por la postnatal, y se observa una mejor eficacia cuando se inició el tratamiento dentro de la primera semana. De hecho, muchos informes de casos que describen el uso de paracetamol comienzan el tratamiento tan pronto como a los 2 o 3 días de edad, lo suficientemente temprano como para que muchos pacientes experimenten un cierre completo. Las tasas de cierre del conducto son más bajas para el curso de 3 días (56%).
Existe una variedad de regímenes de tratamiento informados para el paracetamol, de 7,5 mg a 10 o 15 mg / kg cada 6 horas durante 3 a 7 días. El acetaminofeno se puede administrar por vía oral, a la misma dosis e intervalo, con una eficacia similar a la de la vía intravenosa. Kessel et al mostraron que los niveles de paracetamol en lactantes de 26 a 30 semanas tratados con 15 mg / kg por día por vía oral se mantuvieron principalmente dentro del rango recomendado de 10 a 20 mg / ml para analgesia antes del quinto y noveno dosis, con solo 2 de 8 pacientes excediendo el rango deseado antes de la novena dosis.
El tratamiento con paracetamol puede estar asociado con un aumento de la concentración sérica de enzimas hepáticas en niños y adultos. Esto se ha informado en bebés prematuros después de tan solo 4 dosis de 15 mg / kg por día. Se ha informado una resolución espontánea en todos los casos después del cese de la administración de paracetamol. La inmadurez de las enzimas CYP hepáticas responsables del metabolismo del paracetamol puede proteger contra la toxicidad a corto plazo en los recién nacidos prematuros; sin embargo, se debe tener precaución porque aún es posible una lesión hepática.
Ya sea que se retenga o no la nutrición enteral cuando un paciente tiene un PDA significativo o durante el tratamiento farmacológico ha sido durante mucho tiempo una fuente de variabilidad en la práctica. Un PDA hemodinámicamente significativo puede reducir el flujo sanguíneo hacia la arteria mesentérica superior durante la diástole, y la indometacina reduce de forma aguda el flujo sanguíneo intestinal. Por otro lado, el ayuno se asocia con atrofia de la mucosa intestinal que podría aumentar el riesgo de ECN. Un ensayo de lactantes prematuros tratados con indometacina o ibuprofeno y aleatorizado para recibir 15 ml / kg de alimentación por día o rápido durante el tratamiento (tratamiento rápido) no mostró diferencias en las tasas de ECN, y los pacientes asignados al azar para continuar con la alimentación alcanzaron la alimentación completa antes que los bebés cuyas alimentaciones se mantuvieron.
Ligadura
La ligadura quirúrgica se realiza cuando un neonato tiene un PDA hemodinámicamente significativo que produce disfunción cardíaca, insuficiencia renal o insuficiencia respiratoria. La ligadura se realiza normalmente con un abordaje torácico abierto, ya sea utilizando un clip de metal o atando el vaso. Los abordajes intravasculares con la colocación de una bobina oclusiva están disponibles para pacientes que pesan más de 5 kg. Se están realizando ensayos con productos en desarrollo para lograr el cierre de PDA con catéter en pacientes más pequeños.
La ligadura de DAP se asocia con muchos efectos adversos: parálisis de las cuerdas vocales, hipotensión postoperatoria, parálisis del diafragma, displasia broncopulmonar y peor desarrollo neurológico. La ligadura temprana de DAP es un factor de riesgo independiente para la DBP y un peor desarrollo neurológico en comparación con la ligadura en una edad posterior. No parece haber un mayor riesgo de complicaciones mayores cuando los bebés que han fallado el tratamiento con indometacina pero no tienen compromiso cardiopulmonar se tratan de forma conservadora, en lugar de tratarse con ligadura. Sin embargo, los resultados deficientes después de la ligadura de PDA pueden ser sobreestimados por el diseño del ensayo, lo que sugiere que los abordajes quirúrgicos merecen una consideración completa para los lactantes con PDA sintomática refractaria.
CONCLUSIÓN
DAP sigue siendo una condición importante entre los bebés prematuros nacidos con menos de 28 semanas de gestación. Los avances recientes incluyen la adición de paracetamol (paracetamol) al arsenal de tratamientos disponibles, y un apoyo adicional para el manejo conservador de DAP asintomático o levemente sintomático, antes de considerar el tratamiento farmacológico. Todavía se necesitan mejoras con respecto a los criterios ecocardiográficos estandarizados, el momento óptimo del tratamiento (cuando esté indicado), los regímenes de dosificación para el paracetamol y el desarrollo de dispositivos oclusivos endovasculares para prematuros más pequeños.