Arritmias perinatales
Diciembre 2014
Arritmias perinatales
Nicole Sekarski ; Eur J Pediatr (2014) 173:983–996
Abbreviations
ABC Airway, breathing, circulation AET Atrial ectopic tachycardia APB Atrial premature beat AV Atrioventricular
AVB Atrioventricular block AVNRT Atrioventricular nodal reentrant tachycardia AVRT Atrioventricular reentrant tachycardia
CHD Congenital heart disease JPB Junctional premature beat JET Junctional ectopic tachycardia
PALS Pediatric advanced life support PJRT Permanent junctional reciprocating tachycardia SVT Supraventricular tachycardia
VPB Ventricular premature beat VT Ventricular tachycardia WPW Wolff-Parkinson-White syndrome
Introducción
Las arritmias ocurren tan pronto como el corazón comienza a latir y terminan con una arritmia irreversible final cuando morimos. La misma definición, la clasificación y terapias se aplican desde fetos a la edad adulta. Se observan en aproximadamente 2% de los embarazos y representan el 10 - 20% de las referencias a las unidades de cardiología fetal [13,20].
La prevalencia de arritmias en lactantes normales (niños hasta la edad de 12 meses) es difícil de estimar, variando de 0,75 a 14% y es mayor en niños con cardiopatía congénita (CHD) [7,32]. La arritmia es también una causa frecuente de referencias a cardiología pediátrica , a fin de descartar condiciones que amenazan la vida. revisaremos la clasificación, diagnóstico, manejo y los outcomes de las arritmias en fetos y recién nacidos (menor de 28 días de edad) .
Desarrollo del sistema de conducción
El primer latido del corazón se produce a las 3 semanas después de la concepción cuando el corazón es sólo una estructura tubular primitiva. La remodelación morfológica principal se produce simultáneamente con el desarrollo del sistema de conducción cardiaca, lo que se traduce a las 7 semanas de gestación en un corazón de cuatro cámaras con contracción sincrónica de las cámaras auriculares y ventriculares a una frecuencia de aproximadamente 110 lpm.
Progresivamente, el nodo sinusal actúa como el marcapasos primario y la frecuencia cardíaca alcanza 170 lpm a las 9 a 10 semanas. Más tarde en la gestación, la frecuencia cardíaca disminuye lentamente. Entre 20 y 40 semanas de gestación, la frecuencia cardíaca es regular, con un rango de 110 a 180 latidos por minuto y una variación máxima de latido a latido de 15 latidos por minuto [20,44]. Después del nacimiento, la frecuencia cardíaca disminuye lentamente y se han publicado datos normales para todos los intervalos de tiempo del electrocardiograma (ECG) incluyendo la frecuencia cardíaca y el eje de onda cardíaca (Tabla 1) [9].

Análisis del ritmo
Durante la vida fetal, un ECG fetal en tiempo real no se puede obtener debido al campo eléctrico generado por el corazón materno y los músculos abdominales. La Magnetocardiografía permite la grabación del campo magnético del corazón fetal en lugar del campo eléctrico tradicional registrado por ECG. En realidad, es la mejor modalidad para analizar el ritmo cardíaco fetal [36,48]. Sin embargo, esta tecnología está restringida a centros seleccionados debido a su alto costo.
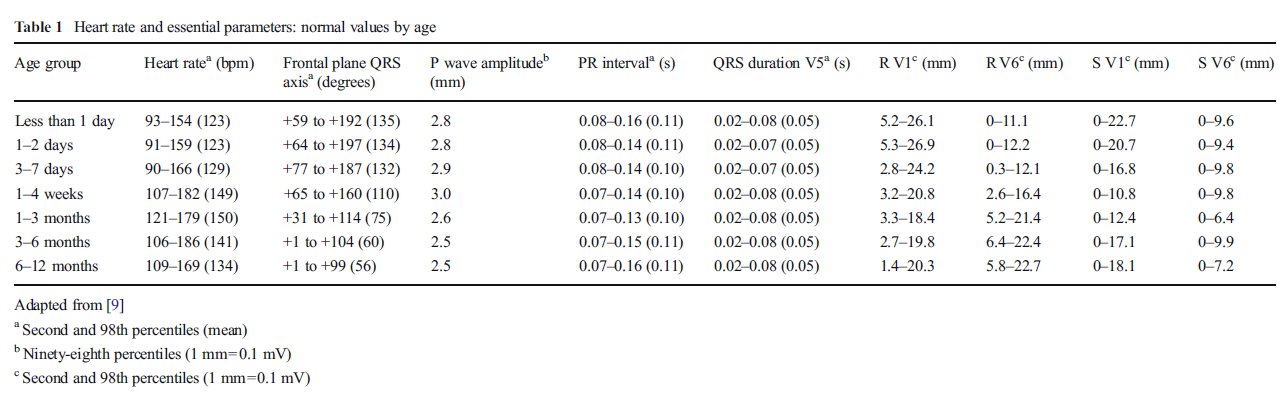
Por lo tanto, el análisis de las arritmias se basa habitualmente en la evaluación de ultrasonido de la relación temporal de las contracciones auriculares y ventriculares. Diferentes modalidades de ultrasonido (modo M, Doppler ó Doppler tisular) permiten la clasificación de las arritmias (Figura 1) [6,13,40].
En algunos casos, la ecocardioecografía puede ser incluso superior al ECG para la evaluación de la arritmia, dado que la contracción auricular se puede identificar incluso cuando el ventrículo se está contrayendo ó durante la fase de repolarización [37]. Un análisis sistemático del trazado de ultrasonido es obligatorio. La interpretación paso a paso del ritmo cardíaco fetal se basa en la determinación del origen del ritmo, la regularidad y la relación entre los eventos y frecuencias aurículares y ventriculares.
El ritmo fetal normal incluye un origen auricular, una contracción auricular y ventricular regular en relación 1: 1 y una frecuencia cardíaca normocárdica. En recién nacidos y lactantes, el análisis del ritmo se basa esencialmente en el ECG de superficie. La interpretación del ECG debe seguir un enfoque inicial similar con evaluación del origen del ritmo, regularidad, relación y frecuencia (nemotecnia : 4R). Además, un análisis cuidadoso de cada onda (P, QRS y T) y de segmentos (PR, QT) en cada derivación añadirá información sobre el tipo de arritmia. Tanto para el diagnóstico y tratamiento, es esencial distinguir un QRS ancho ó estrecho. Debe descartarse Preexcitación (onda delta) ó intervalo QT prolongado.
Ritmo irregular - Latidos prematuros
Definición
Un latido prematuro, también llamado contracción prematura, latido ectópico ó extrasístole puede originarse desde las aurículas, la unión auriculoventricular ó el ventrículo y no pasan por el nodo sinusal. Es lejos el tipo más común de arritmia encontrada durante el período perinatal y su incidencia en pacientes sanos varía mucho dependiendo de la duración de la evaluación del ritmo cardíaco desde 1%, cuando se basa en un único ECG de superficie hasta más de 50 % cuando se basa en una monitorización del ritmo cardíaco de 24 h [17,46].
Latidos auriculares prematuros (APB)
Incidencia
APB son responsables de cerca del 90% del ritmo irregular en fetos y lactantes [17,22].
Diagnóstico
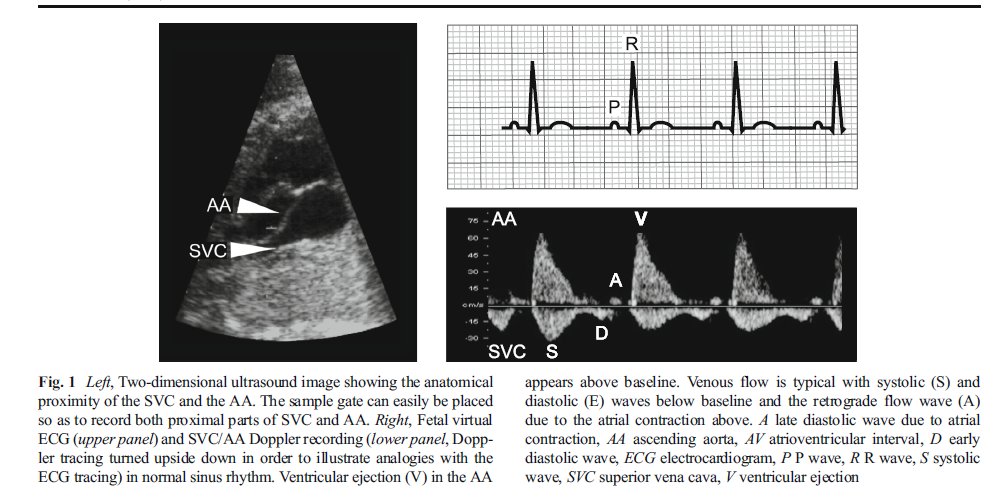
En un registro Doppler ó ECG, el APB se define como un latido prematuro originado en las aurículas, que puede ser conducido (generando una contracción ventricular) ó bloqueado (no conducido a través del nodo auriculoventricular (AV)) (Figura 2).
Prenatalmente, la demostración del origen auricular del extrasístole se basa en el análisis de la sincronización de la contracción auricular y el fenómeno de reseteo del nodo sinusal con APB resultante en menos que pausa compensadora completa.
Postnatalmente, en el ECG, onda P resultante de una APB (llamada P ') por lo general tiene una morfología diferente de la onda P sinusal. La morfología del QRS también es útil ya que la mayoría de las veces se observa un QRS estrecho con morfología similar al QRS sinusal después de un APB. Una onda P 'es a veces visible en la onda T precedente (Figura 2).
Manejo
Dado que las arritmias pueden estar asociadas con malformaciones cardíacas [50], es importante asegurarse de que se realice una ecografía de screening fetal a mediados de trimestre para descartar anomalías cardiacas fetales. Si los APB son muy frecuentes (más de 5 por minuto), persisten por más de 3 semanas ó se asocian con signos de insuficiencia cardíaca ó anomalías extracardíacas, se recomienda llevar a cabo una detallada ecografía cardíaca fetal [13]. Un monitoreo semanal de la frecuencia cardíaca fetal se recomienda siempre que la arritmia persista para detectar la aparición de taquicardia supraventricular (TSV). En efecto, la susceptibilidad a insuficiencia cardíaca en fetos con TSV y la incapacidad de observar manifestaciones clínicas justifican esta estrategia. Después del nacimiento, si la historia clínica y el examen físico descartan cualquier signo ó síntoma cardíaco y el ECG es normal para la edad, excepto por el latido prematuro, no se recomiendan monitoreo ó investigación dicional. Las excepciones son APB frecuentes y APB originados en múltiples focos vistos como ondas P con diferentes morfologías en el ECG de superficie [52].
Outcome
Los APBs son en su mayoría benignos y permanecen autolimitados con resolución espontánea después del diagnóstico de la arritmia antes del nacimiento en el 95% de los fetos y al 1 año de edad en el 95% de los lactantes [46]. No se encontró asociación con muerte súbita del lactante ó cualquier otros problemas clínicos graves nunca se ha descrito. La inmadurez de las vías de conducción en los fetos se caracteriza por un mayor número de vías accesorias que conectan el miocardio auricular y ventricular y una alta tasa de APB [31]. Ambos fenómenos son responsables de la incidencia peak de TSV por un mecanismo auriculoventricular (AV) de reentrada durante la vida fetal, que ocurre en aproximadamente 1 a 3% de los fetos con APB [13,20].
Después del nacimiento, con la maduración de las vías de conducción, tanto APBs como TSVs tienden a ser autolimitadas [45]. Ocasionalmente, APB puede estar asociada con malformaciones cardíacas, tales como defecto septal auricular. En los neonatos enfermos, otras causas deben descartarse : problemas mecánicos (vía venosa central, distensión auricular), anomalías metabólicas (hipo ó hiperpotasemia, hipercalcemia, hipoglicemia, hipoxia), causas farmacológicas (antiarrítmicos, inotrópicos) ó cirugía cardíaca previa (cicatriz auricular).
Latidos ventriculares prematuros (VPB)
Incidencia
VPB en fetos son raros y representan menos del 2% de los latidos prematuros fetales. Después del nacimiento, la incidencia de VPBs en neonatos es más alta en el período neonatal y disminuye rápidamente a partir de entonces (incidencia de VPBs ECG ambulatorio de 24 horas disminuye de 18 a 6%, respectivamente) [17]. Por lo tanto, algunos autores consideran al VPB neonatal aislado monomórfico una variación del ritmo normal [53].
Diagnóstico
AVPB se diagnostica cuando, en un Doppler ó registro ECG , se observa un latido ventricular prematuro sin ninguna alteración de la frecuencia auricular, dando lugar a una pausa compensatoria completa después del latido extra (Figura 3). En el ECG, un amplio QRS prematuro, por lo general con una morfología diferente que el QRS anterior, hace el diagnóstico más fácil después del nacimiento.
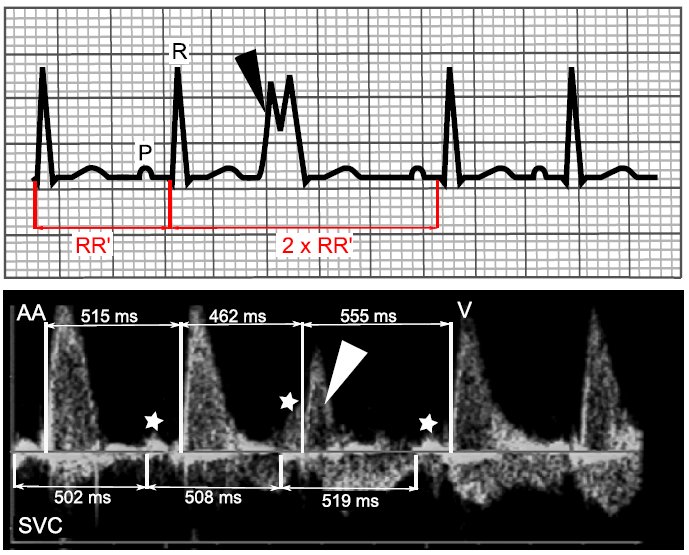
Figura 3 Upper panel, surface ECG: VPB is diagnosed when a wide premature QRS complex (black arrowhead) is observed on surface ECG. Since in rare instances a wide QRS could result from an APB, another feature of VPB is that the interval between the preceding and the following sinus beat is equal to twice the time between two regular sinus beats. This phenomenon called “full compensatory pause” is due, in contrast to APB, to the absence of resetting of the sinus node in VPB. Lower panel, SVC/AA Doppler recording: prenatally, since ECG is not obtainable, this phenomenon is essential to the diagnosis. RR′ interval before the VPB (white arrowhead) is 515 ms. The interval from the preceding and the following regular ventricular beat equals 1,017 ms, approximately twice the RR′ interval (=1,030 ms). Another feature is the identification of regular atrial contractions (white stars), independent of the premature ventricular contraction. AA ascending aorta, P Pwave, R R wave, SVC superior vena cava, V ventricular contraction.
Manejo
Prenatalmente, se debe realizar un cuidadoso examen de la anatomía y función cardiaca para detectar malformaciones ó signos de insuficiencia cardíaca. Se recomienda monitoreo semanal de la frecuencia cardíaca fetal mientras la arritmia persista [13,20]. Después del nacimiento, además de una historia médica cardiovascular orientada y un examen físico, se debe obtener un ECG. Pero no hay acuerdo sobre el manejo de VPB diagnosticado después del nacimiento.
Los manejos propuestos son los siguientes : ninguna investigación adicional, repetición de ECG con intervalos de 1 ó 2 meses, realizar monitoreo ECG 24 horas ambulatorio para buscar mayor grado de actividad ectópica (latidos prematuros no aislados ó polimórficos) y derivación a un cardiólogo pediátrico para estudio cardiovascular [27,52]. Creemos que si la historia clínica (personal y familiar) y el examen físico no muestran síntomas ó signos cardiovasculares y si un cardiólogo pediatra ha descartado anomalías que sugieran una enfermedad miocárdica subyacente en el ECG, es razonable repetir el ECG más allá del período neonatal y realizar un estudio cardiovascular en aquellos pacientes que muestran ritmo irregular persistente en la auscultación ó ECG.
Outcome
El pronóstico de VPB también es benigno en la mayoría de los casos. Sin embargo, puede ser una manifestación de una enfermedad miocárdica subyacente grave, tales como malformaciones cardíacas, tumores ó miocardiopatías. En la mayoría de los casos, éstos pueden ser descartados por la historia clínica, el examen físico y ECG.
Latidos Junctional prematuros (JPB)
JPB describe latidos prematuros originados en la zona del nodo AV. Rara vez se describen en fetos y lactantes. El diagnóstico prenatal es un desafío porque la diferenciación con VPB podría ser imposible. En el ECG, un QRS estrecho precoz no precedido por ninguna onda P es diagnóstico. El pronóstico y manejo son similares a los de los APBs [52].
Taquicardia
Definición
Taquicardia se define como un área del corazón que despolariza más rápido que el rango normal para la edad durante al menos tres latidos consecutivos, por encima de 180 lpm en el feto entre 20 y 40 semanas de gestación y por sobre 200 lpm en neonatos. Al igual que los extrasístoles, el origen supraventricular es, con mucho, la causa más frecuente, siendo infrecuentes los orígenes AV nodal y ventricular en fetos y neonatos sanos.
En los fetos, el 70% de las taquiarritmias son taquicardia paroxística por reentrada AV, 24% taquicardias auriculares primarias (flutter auricular en su mayoría) y 6% taquicardia sinusal [22].
En los neonatos el 80% de la taquicardia no sinusal son taquicardia por reentrada AV, 15% son taquicardia auricular primaria (flutter auricular en su mayoría) y 5% son TSV por reentrada nodal AV [32].
El mecanismo electrofisiológico de todas las TSV se describe en Tabla 2. Durante el periodo perinatal y lactancia, un circuito de reentrada es lejos el mecanismo más común. El circuito de reentrada involucra a las aurículas y ventrículos, con la vía anormal que cruza el surco AV en la taquic ardia por reentrada AV y dentro ó justo al lado del nodo AV en la taquicardia por reentrada nodal AV ó limitada a las aurículas en el flutter auricular (FA).
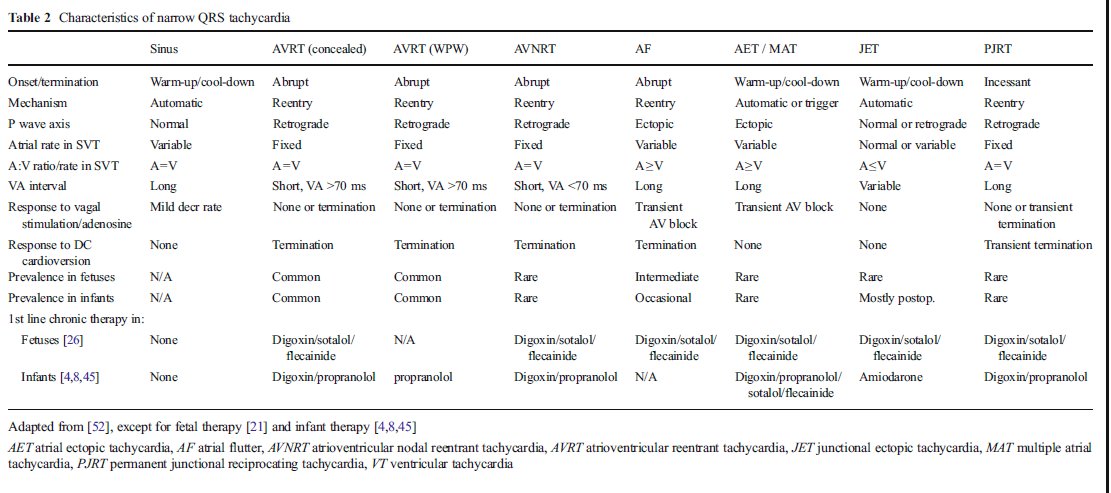
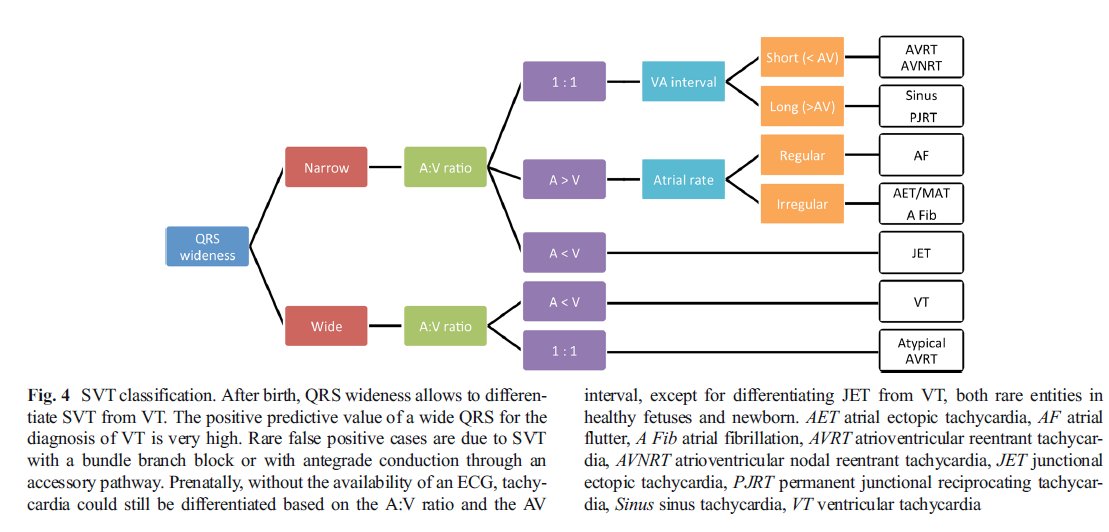
Para el propósito de claridad, vamos a utilizar una terminología común basada en la cámara cardiaca despolarizada para caracterizar la TSV en registros Doppler y ECG. Esto significa que en vez de las tradicionales ondas P, QRS e intervalo PR, vamos a utilizar los términos A (correspondiente a actividad ó evento auricular), V (correspondiente a actividad ó evento ventricular) e intervalo AV [52]. Esto permite diferenciar las taquicardias en base a la relación de eventos auriculares versus ventriculares : = 1, > 1 ó < 1 y en el intervalo de tiempo entre estos eventos : intervalo VA < intervalo AV, llamada TSV con corto VA; ó intervalo VA > intervalo AV, llamada TSV de VA largo (Tabla 2, Figura 4).
Taquicardia supraventricular
Incidencia
La incidencia de TSV fetal es de aproximadamente 1: 3.700 embarazos [50]. Es responsable de aproximadamente 5 a 10% de todas las arritmias fetales, pero más del 50% de aquellas clínicamente significativas [22]. Postnatalmente, la incidencia oscila entre 1: 250 y 1: 1.000 niños, con una incidencia máxima en el período neonatal [17].
Diagnóstico
La determinación del tipo de TSV se basa en la evaluación de la relación AV y otras características específicas (ver Tabla 2 y Figuras 4 y 5). En base a ello, deben descartarse taquicardia sinusal y taquicardia ventricular ya que su manejo y pronóstico difieren considerablemente de TSVT no sinusal. Debe buscarse factores que provocan TSV no sinusal en el feto : cardiopatía congénita (CHD) coexistente, hipertiroidismo ó consumo de cafeína, alcohol ó tabaco materno. Estas últimas causas se encuentran entre las más frecuentes [49].
La taquicardia sinusal es la causa más común de taquicardia de largo VA y la frecuencia cardiaca es generalmente más baja que en otras TSV con aceleración gradual frecuente y desaceleración. Las contracciones auriculares permanecen siempre claramente visibles en registro Doppler prenatalmente, pero en el ECG, las ondas P pueden estar transitoriamente ocultas en las ondas T y visibles sólo cuando la frecuencia cardíaca se desacelera. La fiebre materna, uso de drogas ó hipertiroidismo e hipoxemia son la causa más frecuente en los fetos. Durante la infancia, se encuentran las mismas causas, pero la hipovolemia por deshidratación o shock es la principal causa [18].
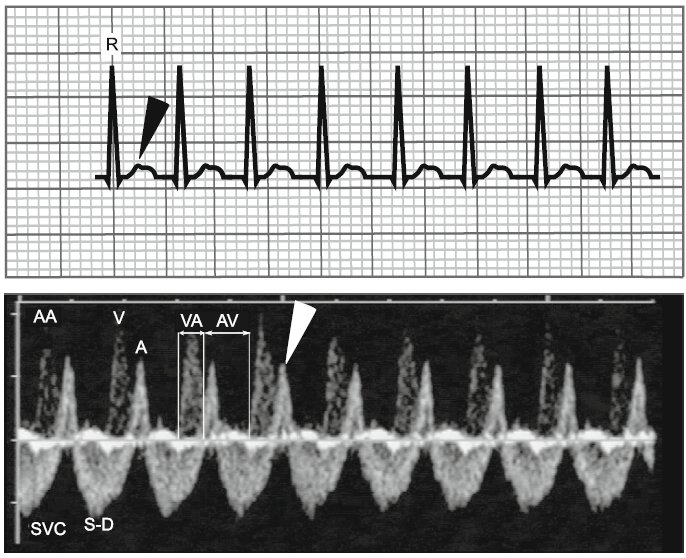
Figura 5 .- TSV típica con intervalo VA corto. Se observa taquicardia QRS estrecho en ECG de superficie (panel superior) . Si observamos con atención la onda T, puede observarse una pequeña deflexión (punta de flecha negro) algunas veces la cual corresponde a la despolarización retrógrada de las aurículas. Prenatalmente (panel inferior), tambien se observa una taquicardia en el registro Doppler basado en la frecuencia ventricular, pero las contracciones auriculares son muy claramente identificables siguiendo poco después cada despolarización ventricular. Este fenómeno llamado canon onda A se debe a la ocurrencia de la contracción aurícular antes de la apertura de la válvula tricúspide (el ventrículo aún se está contrayendo y eyectándose sangre). El intervalo VA es mucho menor que el intervalo AV, 83 y 171 ms, respectivamente, para una frecuencia cardiaca de 240 lpm.
"A" onda diastólica tardía debida a contracción auricular, AA aorta ascendente, AV intervalo auriculoventricular, D onda diastólica precoz, onda RR, S onda sistólica, SVC vena cava superior, V eyección ventricular, VA intervalo ventriculoatrial
Manejo
Tratamiento agudo : La clasificación de TSV es el paso principal para establecer un pronóstico y guiar la terapia. Prenatalmente, debido al riesgo de una rápida progresión a insuficiencia cardiaca y la dificultad para convertir TSV en un feto hidrópico, toda TSV persistente in útero debe ser tratada cuando el parto no es una opción [13,20].
Los fármacos antiarrítmicos se han utilizado durante años y los efectos adversos para la madre y el feto son raros. Sin embargo, cualquier administración de fármaco a un individuo sano, la madre, es preocupante y es mandatoria una cuidadosa introducción y monitoreo.
La elección del fármaco dependerá sobre todo del estado del feto (signos de insuficiencia cardíaca, hidropesía fetal), así como tambien del tipo de TSV. Dado que no se han realizado estudios controlados, randomizados, prospectivos (RCT) , hasta la fecha no hay acuerdo sobre el mejor antiarrítmico. Esto debe ser resuelto en un futuro cercano con el RCT multicéntrico internacional planificado por Jaeggi et al. Debido a su eficacia y seguridad, digoxina, sotalol y flecainida son los agentes de primera línea más utilizados (Tabla 2).
Todas permiten monitoreo de la dosis basado en su nivel sérico materno (nivel sérico de sotalol y flecainida podría no estar disponible en algunos centros) y la medición del intervalo QT corregido en el ECG materno. Combinación de antiarrítmicos ó antiarrítmicos de segunda línea (propafenona, amiodarona) pueden usarse en fetos hidrópicos (Tabla 2). De hecho, en esta situación, la tasa de conversión disminuye a menos del 25% con digoxina sola y por lo general una mediana de 2 medicamentos son necesarios para convertir a ritmo sinusal [20]. Actualmente, se utilizan más comúnmente las combinaciones de flecainida + digoxina y sotalol + digoxina. En los casos graves, cuando todas las terapias transplacentarias han fallado, la administración directa de agentes antiarrítmicos, ya sea a través de la administración intravenosa transumbilical ó intramuscular fetal puede intentarse.
El tratamiento agudo de TSV en neonatos y lactantes se basa en las guías del soporte vital avanzado pediátrico (PALS) de la American Heart Association [29].
TSV probable con pulso y mala perfusión debe ser manejada de la siguiente manera: Estado de ABC (es decir, vías aéreas, respiración y circulación), suministro de oxígeno, monitoreo cardíaco y acceso IV.
Si el registro ECG confirma TSV y el paciente está inestable, debe realizarse de inmediato cardioversión eléctrica sincronizada 0,5-1 J / kg .
Si el paciente está hemodinámicamente estable, pueden realizarse maniobras vagales siempre y cuando la administración de adenosina no se retrase.
Las maniobras vagales incluyen reflejo de inmersión y colocación de una bolsa de hielo en la cara de los niños. Una mezcla de hielo triturado con agua en una bolsa de plástico ó guante se debe aplicar en el rostro infantil por 10 a 15 segundos sin comprometer su respiración. En un paciente estable, esto podría ser repetido una vez. El masaje del seno carotídeo y la presión ocular no se recomiendan debido a asistolía prolongada y potencial desprendimiento de retina, respectivamente.
Si no tiene éxito, debe administrarse adenosina a una dosis inicial de 0,1 mg / kg (máximo 6 mg) por vía intravenosa en bolo rápido seguido por flush de solución salina administrada tan cerca del paciente como sea posible en el mayor acceso intravenoso. Con frecuencia no se obtiene la conversión a ritmo sinusal con la dosis inicial, especialmente en neonatos con menos de 25 % de conversión con 0,1 mg / kg [11]. Por lo tanto, la dosis debe aumentarse progresivamente hasta 0,3 mg / kg (máximo 12 mg) [39].
La administración a través de catéter en arteria umbilical es la única ruta contraindicada debido a la rápida metabolización de adenosina antes de que llegue al miocardio [30]. Adenosina actúa bloqueando el nodo AV y, por lo tanto, sólo termina las arritmias que implican el nodo AV, tales como la taquicardia por reentrada AV (TAVR) ó taquicardia por reentrada intranodal (TAVRT). No logra terminar las taquicardias auriculares primarios tales como AF, pero se ralentizará la conducción AV y a menudo desenmascara las arritmias subyacentes. Por tanto, es esencial registrar el trazado de ECG durante su administración.
La adenosina es muy eficaz para la terminación de TSV y tambien segura debido a la su corta vida media (menos de 10 s) . Los efectos secundarios mayores son poco frecuentes e incluyen bradicardia severa, asistolia, fibrilación auricular, bloqueos AV, arritmias ventriculares y broncoespasmo. Por lo tanto, durante su administración, un carro de paro debe estar disponible al lado de la cuna.
En los casos en que no se recomienda la adenosina ó no tiene éxito, un cardiólogo pediátrico debe ser consultado para su manejo ulterior, ya sea cardioversión eléctrica, sobre estimulación a través de cables esofágicos ó administración de fármacos antiarrítmicos.
La insuficiencia cardíaca aguda a veces se
encuentra en taquicardia de larga duración. En esta situación, el rápido
restablecimiento del ritmo sinusal es crucial y maniobras vagales e inotrópicos negativos deben ser evitados. En este
escenario la digoxina es
una opción valiosa para el tratamiento agudo y de largo plazo.
AF es manejada antes del nacimiento mediante la administración
transplacentaria de antiarrítmico (Tabla 2, Figura 4). La conversión a ritmo sinusal
es muy eficaz con la administración de sotalol [34]. Postnatalmente,
la cardioversión eléctrica es la primera opción de terapia, ya sea por la
sobreestimulación auricular ó cardioversión sincronizada de corriente continua
[3].
Terapia a largo plazo
La duración de la terapia depende ampliamente del tipo de taquicardia y de las dificultades encontradas para convertirla. Existe muy poca información sobre el manejo postnatal para los fetos diagnosticados con TSV. Dos estrategias se utilizan principalmente ya sea suspender todas las terapias al nacimiento ó continuar antiarrítmicos profilácticamente durante 6 a 12 meses. La primera opción es preferida para TSV corto VA fácilmente convertida con un solo fármaco debido a la baja tasa de recurrencia y la segunda para todos los demás casos (TSV largo VA, TSV corto VA que requiere más de un antiarrítmico) [24].
Debido a una muy baja tasa de recurrencia después de exitosa conversión de flutter auricular, no se recomienda tratamiento antiarrítmico crónico ni en fetos ni en lactantes [24,34]. Sin embargo, es importante enseñar a los padres los signos que podrían reflejar una TSV recurrente: irritabilidad, mala alimentación, palidez, diaforesis y taquipnea. Dado que estos signos pueden ser sutiles y también a causa de la ansiedad de los padres, algunos proponen enseñar a los padres chequesr la frecuencia cardíaca de su bebé durante el sueño ó durante alimentación ya sea colocando su mano sobre el pecho del niño ó usando un estetoscopio [28].
Postnatalmente, si una TSV de corto VA recurrió ó se ha diagnosticado recientemente, una terapia crónica se inicia generalmente en los bebés para prevenir episodios posteriores. Las drogas más utilizadas son la digoxina y propanolol con eficiencia similar [45]. Sin embargo, ya que la digoxina acelera la conducción a través de las vías accesorias (AP), actualmente se evita sobre todo en niños con síndrome de WPW debido al riesgo de fibrilación ventricular en caso de fibrilación auricular [16,32]. Otros antiarrítmicos utilizados con frecuencia son sotalol, flecainida, propafenona y amiodarona.
La terapia a largo plazo generalmente se suspende después de 6 a 12 meses. En caso de recurrencia de TSV después de suspensión del tratamiento médico, la terapia antiarrítmica se mantiene durante un período más largo.
Otras formas raras de TSV, como taquicardia auricular ectópica (AET), taquicardia recíproca de la unión permanentes (PJRT) y taquicardia ectópica de la unión (JET), son a menudo más difíciles de tratar médicamente que la TSV a corto VA.
Ellos responden mal al manejo agudo con la administración de adenosina, sobreestimulación auricular con electrodos ó cardioversión de corriente continua. A menudo requieren múltiples tratamientos dirigidos a controlar al menos la frecuencia cardíaca de la taquicardia cuando la conversión a ritmo sinusal no es lograble.
Hasta hace poco, la ablación por radiofrecuencia en niños menores de 5 años de edad y con peso inferior a 15 kg se restringía a arritmias malignas ó mal toleradas [16]. Con la mejora de las tecnologías y experiencia, ahora es una alternativa segura y eficaz en lactantes [5]. La ablación con catéter se debe considerar a cualquier edad para TSV asociada con muerte súbita abortada, episodios sincopales relacionados con arritmia, disfunción ventricular, refractariedad a tratamiento con múltiples fármacos ó efectos secundarios graves relacionados con fármacos [3,5]. Este procedimiento debe ser realizado sólo en manos experimentadas.
Outcome
Los estudios muestran que la tasa de recurrencia de TSV paroxística es la más baja para casos prenatales y luego inversamente relacionada con la edad al momento del diagnóstico inicial [41]. Los pacientes con TSV inicial durante la lactancia tienen ausencia de TSV al 1 año de edad de 90%, pero aproximadamente un tercio de ellos pueden tener recurrencias durante la infancia. La razón de la baja tasa de recurrencia en los casos prenatales radica probablemente en dos fenómenos: la desaparición progresiva de las vías accesorias musculares que conectan las aurículas y los ventrículos dado el corazón del bebé crece y la baja tasa de latidos prematuros como eventos de inicio durante la lactancia [19].
En la época reciente, la TSV fetal en fetos hidrópicos aún se asocia con una mortalidad significativa (de hasta 17%) y tasa de morbilidad (alteraciones neurológicas reportadas en 10 a 20% de los casos, incluso después de un tratamiento exitoso) [23,38].
Taquicardia ventricular
Incidencia
TV es muy poco frecuente en los fetos y los recién nacidos, representando menos del 1% de todas las taquiarritmias y con una incidencia de 0,3 episodios / 100.000 lactantes [16,42]. Una cardiopatía estructural subyacente (miocardiopatía hipertrófica, síndrome de QT largo, displasia del ventrículo derecho, no compactación del ventrículo izquierdo, malformación cardíaca congénita) está presente en aproximadamente la mitad de los casos pediátricos.
Diagnóstico
Prenatalmente, el diagnóstico es difícil, pero se debe sospechar si se observa disociación AV con más contracciones ventriculares que auriculares en eco fetal. Después del nacimiento, el diagnóstico se hace si, en el ECG, hay más de tres latidos consecutivos de QRS ancho de origen ventricular que ocurren a un ritmo más rápido que el ritmo subyacente.
Una causa benigna rara de taquicardia de QRS ancho en recién nacidos es el ritmo idioventricular acelerado, caracterizado por un QRS ancho en el ECG con una frecuencia ligeramente mayor que el ritmo sinusal que prevalece en un paciente perfectamente asintomático. Conversión espontánea a ritmo sinusal puede observarse cuando la frecuencia cardíaca se eleva debido a agitación del niño. La etiología es desconocida y es siempre autolimitado y benigno y nunca evoluciona hacia TV [14,42].
Manejo
El tratamiento prenatal incluye beta-bloqueadores, flecainida, sotalol, lidocaína y amiodarona, pero debido al número muy limitado de casos, la tasa de éxito del tratamiento no está claramente establecida y un agente de primera línea queda por establecer. La amiodarona y sotalol han demostrado tener éxito, pero hay preocupaciones sobre sus efectos secundarios proarrítmicos en caso de LQTS asociado. Por lo tanto, algunos abogan por el uso de la flecainida ó propranolol, lo que disminuye el intervalo QT y por lo tanto el riesgo de inducir torsades de pointes.
Postnatalmente, el manejo de TV sostenida también sigue las guías de American Heart Association PALS: estado ABC, oxígenoterapia, monitoreo cardíaco y acceso IV y registro ECG para la evaluación del ritmo y cardioversión eléctrica sincronizada de 0,5 a 1 J / kg. Neonatos hemodinámicamente estables con TV pueden ser manejados con administración de fármacos lidocaína ó amiodarona [10,33]. En el escenario de QT prolongado y torsades de pointes (taquicardia ventricular polimórfica), sulfato de magnesio intravenoso es el tratamiento de elección. El tratamiento a largo plazo aún debe ser establecido, ya que, sin la aparición de eventos que amenazan la vida ó muerte , la resolución de TV ocurre con y sin medicamentos antiarrítmicos ambulatorios [33].
Outcome
El outcome de TV depende de su etiología. Cardiopatía congénita , miocardiopatías (hipertrófica, miocardiopatía arritmogénica del ventrículo derecho), síndrome de QT largo y tumores cardíacos se asocian con un mal resultado. La mortalidad reportada es 36% en esta población [42]. A la inversa, en la mitad de los fetos y lactantes se observa TV en individuos aparentemente sanos y se asocia con un buen pronóstico [10,33,42].
Bradicardia
Definición
La bradicardia se define como un área del corazón que despolariza más lento que el rango normal para la edad durante al menos tres latidos sucesivos. Una frecuencia ventricular en fetos y lactantes menor de 110 latidos por minuto y por debajo de 100 latidos por minuto, respectivamente, se considera por lo general como bradicardia [9,13].
Incidencia
La bradicardia representa menos del 5% de derivación por arritmia en fetos y recién nacidos [13].
Etiología
La causa más común es la bradicardia sinusal. La bradicardia sinusal transitoria es a menudo secundaria a estimulación vagal, que ocurre con frecuencia durante la exploración fetal como resultado de la presión aplicada en el abdomen de la madre y también se observa durante el sueño profundo, vómitos y defecación en los lactantes [47]. La bradicardia sinusal persistente suele estar relacionada con insuficiencia cardíaca e hidrops en fetos, pero también puede ser causada por hipotermia materna ó síndrome de QT largo.
En lactantes la bradicardia sinusal sostenida se relaciona principalmente con disfunción de nódulo sinusal secundaria (Tabla 3).
La bradicardia no sinusal consiste en disfunción del nodo sinusal, ya sea idiopática ó relacionada con pre ó post reparación de CHD , bigeminismo auricular bloqueado (Figura 2), bloqueo auriculoventricular de segundo grado 2: 1 ó bloqueo auriculoventricular completo. Los bloqueos auriculoventriculares serán discutidos por separado en la sección siguiente.
Tabla 3.- Causas de bradicardia sinusal en fetos ó lactantes
Primary sinus node dysfunction
Certain myopathies and inflammatory diseases
Following cardiac surgery
Heterotaxy syndrome associated with absent SA node (left isomerism)
Autonomic mediated
Hypervagotonia
Pallid breathholding spells
Long QT syndrome
Medication (antiarrhythmics)
Situational
Vasovagal syncope
Carotid sinus pressure
Eye surgery
Central nervous system
Tumors
Increased intracranial pressure
Meningitis
Metabolic
Hypoxia
Hypothermia
Hypothyroidism
Acidosis
Sepsis
Adapted from [52]
Diagnóstico
In útero la frecuencia de contracción auricular y ventricular y la relación permite la identificación del tipo de bradicardia, ya sea bradicardia sinusal, bigeminismo auricular bloqueado, bloqueo aurículo ventricular 2: 1 ó bloqueo aurículo ventricular completo (Figura 2). Postnatalmente, el diagnóstico se hace fácilmente en el ECG de superficie.
Manejo
Para todas las bradicardias, el manejo depende de la etiología y la gravedad, pero un seguimiento estrecho siempre es necesario con el fin de detectar la aparición de insuficiencia cardíaca.
Outcome
Por lo general, el bigeminismo auricular bloqueado no se asocia con el desarrollo de insuficiencia cardiaca y convierte espontáneamente a ritmo sinusal. El outcome de la bradicardia sinusal depende altamente de la causa subyacente.
Alteraciones de conducción atrioventricular
I.- Bloqueo AV completo
Definición
El bloqueo AV completo es la completa disociación entre contracciones auriculares y ventriculares. Los impulsos auriculares y ventriculares impulsos son generados independientemente uno de otro.
El bloqueo AV completo que ocurre prenatalmente se relaciona igualmente sea con cardiopatías congénitas (isomerismo izquierdo, defecto septal atrioventricular, transposición corregida de grandes arterias) ó con autoanticuerpos maternos (asociada con enfermedades autoinmunes como lupus eritematoso sistémico) [35,47]. Postnatalmente, la mayoría es adquirida después de cirugía para cardiopatía congénita, pero carditis (miocarditis viral y enfermedades de Lyme, carditis esencialmente) y causas idiopáticas pueden encontrarse [35,52].
Diagnóstico
El diagnóstico se hace fácilmente prenatalmente y después del nacimiento mediante la identificación de eventos auriculares y ventriculares, en el Doppler ó registro de ECG, que ocurren de forma independiente el uno del otro a su propio ritmo.
Manejo
Cuando el parto no es una opción, las opciones terapéuticas son limitadas. Se ha sugerido que el bloqueo en segundo grado y Bloqueo AV completo inmune - relacionados podrían beneficiarse de la administración de esteroides transplacentaria para prevenir daño del nodo AV y daño miocárdico fetal pero ésto sigue siendo controvertido [21,26,35,43]. Se ha reportado morbilidad y mortalidad significativa in útero relacionadas principalmente con insuficiencia cardíaca e hidrops , que ocurren en 9-27% de los embarazos con una tasa más alta en aquellos fetos con cardiopatía congénita asociada [25,35].
Dado que con una frecuencia cardiaca bajo
de
55 latidos por minuto el pronóstico parece muy pobre, se han propuesto terapias
destinadas a aumentar la frecuencia cardíaca. Salbutamol transplacentario mostró
algunos efectos en el aumento de la frecuencia ventricular fetal y
reportes de casos describen el uso de la estimulación con electrodos in útero pero el beneficio
clínico de estas terapias aún no se ha demostrado [2,21,26,43].
En contrario al manejo prenatal, el manejo postnatal está más claramente establecido debido a la posibilidad de
implantación de marcapasos. El bloqueo AV avanzado de segundo ó tercer grado después de la
cirugía y persistente más de 7 días requiere la implantación de marcapasos.
El bloqueo AV avanzado de segundo ó tercer grado no quirúrgico podría ser seguido de forma conservadora. El criterio para implantación de marcapaso en los pacientes incluye lo siguiente : falta de crecimiento, síntomas cardiovasculares relacionados con la bradicardia, bajo gasto cardíaco y la frecuencia cardíaca en reposo durante período de lactantes de menos de 55 latidos por minuto [5]. Por último, cualquier niño con bradicardia sinusal sintomática ó incompetencia cronotrópica debe ser referido para implantación de marcapaso [5].
Outcome
Bloqueo AV completo con cardiopatía congénita coexistente tiene el peor pronóstico con una sobrevida de sólo 20-40% más allá del período neonatal [35]. La sobrevida a 1 año para bloqueo completo aislado perinatal es 80 y 90%. La miocardiopatía dilatada se observa en aproximadamente el 25% de los sobrevivientes [43,51].
II.- Bloqueo AV Segundo grado
Definición - diagnóstico - manejo - outcome
En el bloqueo AV de segundo grado, no cada latido auricular es conducido a los ventrículos. El diagnóstico se realiza de manera similar para todos los bloqueos AV mediante la identificación de los latidos auriculares y ventriculares y el latido auricular bloqueado y midiendo el retraso AV.
En el subtipo Mobitz tipo I (Wenckebach), hay un aumento progresivo del retraso de conducción AV que termina en un latido auricular no conducido. Esta condición comparte las mismas causas y pronóstico que el bloqueo AV de primer grado. Es también una condición fisiológica, observada con frecuencia cuando el tono vagal es más prominente, especialmente durante el sueño. Sin embargo, la progresión a grados mayores de bloqueo AV es posible, especialmente si está relacionado a exposición a autoanticuerpos maternos.
Estos tienen que ser buscados prenatalmente y debe indicarse tratamiento adecuado. Una condición cardíaca subyacente también es posible y tiene que ser excluída durante la ecografía prenatal y después del nacimiento por la historia y el examen físico. El paciente debe ser referido a un cardiólogo pediátrico y está indicado un monitoreo de la frecuencia cardiaca ambulatoria de 24 h para observar si la condición es sólo transitoria y relacionada con periodos de elevado tono vagal. Si es así, el seguimiento no es necesario. Para el resto de casos, deben buscarse etiologías y se sugiere seguimiento anualmente.
En bloqueo AV Mobitz tipo II de segundo grado, no hay alargamiento progresivo de la conducción AV, sino más bien una interrupción repentina de la conducción AV. Esta es una condición rara pero más grave que la de tipo I, a menudo relacionada sea con inflamación (autoanticuerpos maternos) ó una lesión traumática. Hay un mayor riesgo de progresión a loqueo AV completo, especialmente para bloqueo AV de segundo grado avanzado (definido como bloqueo de dos o más ondas P consecutivas). Por lo tanto, la implantación de marcapasos está indicada cuando ocurre tal bloqueo después de la cirugía [5]. Su hallazgo casual en un paciente asintomático puede tratarse de forma conservadora, pero merece un seguimiento cuidadoso.
III.- Bloqueo AV de primer grado
Definición - diagnóstico - manejo - outcome
En el bloqueo AV de primer grado, cada latido auricular se conduce a los ventrículos con algún retraso. El diagnóstico se basa en la medición de un prolongado intervalo AV ó PR para la edad en registro Doppler ó ECG. El intervalo AV aumenta ligeramente a través de la gestación y los datos de normalidad varían en función de la técnica utilizada [1,12]. El intervalo PR normal es menos de 160 ms el primer día de vida y disminuye progresivamente hasta 130 ms a los 3 meses de edad [1,9]. Luego su límite superior se eleva hasta 150 ms y a 160 ms de 3 a 6 y de 6 a 12 meses, respectivamente (Tabla 1).
El bloqueo AV de primer grado es una condición benigna y es bien tolerado. No requiere ninguna terapia, pero podría reflejar el daño de autoanticuerpos maternos a la vía de conducción. Esto debe ser considerado para la etapa prenatal y seguido adecuadamente [15]. Una cuidadosa historia clínica y examen físico se tiene que realizar para descartar otras enfermedades cardíacas subyacentes. Este es principalmente una condición benigna, fisiológica en la mayoría de casos, encontrada en niños con altos niveles de tono vagal, especialmente durante el sueño, pero también puede estar asociado con cardiopatías congénitas , medicamento antiarrítmico, hipotiroidismo, inflamación miocárdica ó trauma quirúrgico [52].
Conclusión
Las arritmias en fetos y recién nacidos son muy comunes. La historia, examen físico y grabación de la arritmia son las piedras angulares del manejo . Ecocardiografía Doppler y ECG son los métodos preferidos para los períodos prenatal y postnatal, respectivamente. Los latidos prematuros son casi siempre benignos. Las TSV más comunes, taquicardia AV por reentrada y el flutter auricular, tienen un pronóstico excelente. Medicamentos antiarrítmicos agudos y crónicos están disponibles para tratar y prevenir TSV recurrente hasta que se produzca la resolución espontánea de la taquiarritmia, como es el caso en hasta el 90% de los fetos y neonatos tratados.
Si la terapia falla lo que es más común para las formas más raras de TSV, puede ser una opción el estudio electrofisiológico y ablación por catéter. Debido al aumento de los riesgos de este tipo de procedimientos en los lactantes, tiene que llevarse a cabo en manos experimentadas.
El Bloqueo AV completo es una condición seria con morbilidad y mortalidad significativas, sobre todo cuando se asocia con cardiopatías congénitas y puede necesitar la implantación de marcapaso.
Referencias
Andelfinger G, Fouron JC, Sonesson SE, Proulx F (2001) Reference values for time intervals between atrial and ventricular contractions of the fetal heart measured by two Doppler techniques. AJC 88:1433– 1436– A8
Assad RS, Zielinsky P, Kalil R et al (2003) New lead for in utero pacing for fetal congenital heart block. J Thorac Cardiovasc Surg 126:300–302. doi:10.1016/S0022-5223(03)00220-4
Bauersfeld U, Pfammatter JP, Jaeggi E (2001) Treatment of supraventricular tachycardias in the new millennium—drugs or radiofrequency catheter ablation? Eur J Pediatr 160:1–9
Bonney WJ, Shah MJ (2013) Incessant SVT in children: ectopic atrial tachycardia and permanent junctional reciprocating tachycardia. Progress in Pediatric Cardiology 1–8. doi: 10.1016/j.ppedcard. 2012.11.005
Brugada J, Blom N, Sarquella-Brugada G et al (2013) Pharmacological and non-pharmacological therapy for arrhythmias in the pediatric population: EHRA and AEPCArrhythmia Working Group joint consensus statement. Europace 15:1337–1382. doi:10.1093/europace/eut082
Carvalho JS, Prefumo F, Ciardelli Vet al (2007) Evaluation of fetal arrhythmias from simultaneous pulsed wave Doppler in pulmonary artery and vein. Heart 93:1448–1453. doi:10.1136/hrt.2006.101659
Chiu S-N, Wang J-K, Wu M-H et al (2008) Cardiac conduction disturbance detected in a pediatric population. J Pediatr 152:85–89. doi:10.1016/j.jpeds.2007.05.044
Collins KK, Van Hare GF, Kertesz NJ et al (2009) Pediatric nonpostoperative junctional ectopic tachycardia. JAC 53:690–697. doi:10. 1016/j.jacc.2008.11.019
Davignon A, Rautaharju P, Boisselle E et al (1980) Normal ECG standards for infants and children. Pediatr Cardiol 1:123–152
Davis AM, Gow RM,McCrindle BW, Hamilton RM(1996) Clinical spectrum, therapeutic management, and follow-up of ventricular tachycardia in infants and young children. Am Heart J 131:186–191
Dixon J, Foster K,Wyllie J,Wren C (2005) Guidelines and adenosine dosing in supraventricular tachycardia. Arch Dis Child 90:1190– 1191. doi:10.1136/adc.2005.077636
Epstein AE, DiMarco JP, Ellenbogen KA et al (2008) ACC/AHA/HRS 2008 guidelines for device-based therapy of cardiac rhythm abnormalities: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices): developed in collaboration with the American Association for Thoracic Surgery and Society of Thoracic Surgeons. Circulation 117:e350–408. doi:10.1161/ CIRCUALTIONAHA.108.189742
Fouron J-C (2004) Fetal arrhythmias: the Saint-Justine hospital experience. Prenat Diagn 24:1068–1080. doi:10.1002/pd.1064
Freire G, Dubrow I (2008) Accelerated idioventricular rhythm in newborns: a worrisome but benign entity with or without congenital heart disease. Pediatr Cardiol 29:457–462. doi:10.1007/s00246-007-9024-z
Friedman DM, Kim MY, Copel JA et al (2008) Utility of cardiac monitoring in fetuses at risk for congenital heart block: the PR Interval and Dexamethasone Evaluation (PRIDE) prospective study. Circulation 117:485–493. doi:10.1161/CIRCULATIONAHA.107. 707661
Friedman RA, Walsh EP, Silka MJ, et al. (2002) NASPE Expert Consensus Conference: radiofrequency catheter ablation in children with and without congenital heart disease. Report of the Writing Committee. North American Society of Pacing and Electrophysiology. In: Pacing Clin Electrophysiol. pp 1000–1017
Garson AJ, Gillette PC, McNamara DG (1981) Supraventricular tachycardia in children: clinical features, response to treatment, and long-term follow-up in 217 patients. J Pediatr 98:875–882
GimovskyML, NazirM, Hashemi E, Polcaro J (2004) Fetal/neonatal supraventricular tachycardia. J Perinatol 24:191–193. doi:10.1038/sj. jp.7211036
Hahurij ND, Gittenberger-De Groot AC, Kolditz DP et al (2008) Accessory atrioventricular myocardial connections in the developing human heart: relevance for perinatal supraventricular tachycardias. Circulation 117:2850–2858. doi:10.1161/CIRCULATIONAHA.107. 756288
Hornberger LK, Sahn DJ (2007) Rhythm abnormalities of the fetus. Heart 93:1294–1300. doi:10.1136/hrt.2005.069369
Jaeggi ET (2004) Transplacental fetal treatment improves the outcome of prenatally diagnosed complete atrioventricular block without structural heart disease. Circulation 110:1542–1548. doi:10.1161/01. CIR.0000142046.58632.3A
Jaeggi E (2009) Electrophysiology for the perinatologist. In: Yagel S, SilvermanNH, Gembruch U (eds) Fetal cardiology, 2nd edn. Informa Healthcare London, New York, pp 435–447
Jaeggi ET, Carvalho JS, De Groot E et al (2011) Comparison of transplacental treatment of fetal supraventricular tachyarrhythmias with digoxin, flecainide, and sotalol: results of a nonrandomized multicenter study. Circulation 124:1747–1754. doi:10.1161/ CIRCULATIONAHA.111.026120
Jaeggi E, Fouron JC, Drblik SP (1998) Fetal atrial flutter: diagnosis, clinical features, treatment, and outcome. J Pediatr 132:335–339
Jaeggi ET, Hornberger LK, Smallhorn JF, Fouron JC (2005) Prenatal diagnosis of complete atrioventricular block associated with structural heart disease: combined experience of two tertiary care centers and review of the literature. Ultrasound Obstet Gynecol 26:16–21. doi:10. 1002/uog.1919
Jaeggi ET, Silverman ED, Laskin C et al (2011) Prolongation of the atrioventricular conduction in fetuses exposed to maternal anti-Ro/ SSA and anti-La/SSB antibodies did not predict progressive heart block. JAC 57:1487–1492. doi:10.1016/j.jacc.2010.12.014
Kaltman J, ShahM(2004) Evaluation of the child with an arrhythmia. Pediatr Clin N Am 51:1537–51– viii. doi:10.1016/j.pcl.2004.08.002
KantochMJ (2005) Supraventricular tachycardia in children. Indian J Pediatr 72:609–619
Kleinman ME, Chameides L, Schexnayder SM et al (2010) Part 14: pediatric advanced life support: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 122:S876–908. doi:10.1161/ CIRCULATIONAHA.110.971101
Knick BJ, Saul PJ (2001) Immediate arrhythmia management. In: Zeigler VL, Gillette PC (eds) Practical management of pediatric cardiac arrhythmias. Futura, Armonk, NY, pp 161–230
Ko JK, Deal BJ, Strasburger JF, Benson DW(1992) Supraventricular tachycardia mechanisms and their age distribution in pediatric patients. AJC 69:1028–1032
Lee KW, Badhwar N, Scheinman MM (2008) Supraventricular tachycardia—part I. Curr Probl Cardiol 33:467–546. doi:10.1016/j. cpcardiol.2008.06.002
LevinMD, Stephens P, Tanel RE et al (2010) Ventricular tachycardia in infants with structurally normal heart: a benign disorder. Cardiol Young 20:641–647. doi:10.1017/S1047951110000867
Lisowski LA, Verheijen PM, Benatar AA et al (2000) Atrial flutter in the perinatal age group: diagnosis, management and outcome. JAC 35:771–777
Lopes LM, Tavares GMP, Damiano AP et al (2008) Perinatal outcome of fetal atrioventricular block: one-hundred-sixteen cases from a single institution. Circulation 118:1268–1275. doi:10.1161/ CIRCULATIONAHA.107.735118
Mivelaz Y (2014) Electrophysiology of the fetal heart assessed by magnetocardiography: a hidden area revealed but with some limitations. Heart Rhythm. doi:10.1016/j.hrthm.2013.12.040
Mivelaz Y, Sarquella-Brugada G, Fournier A, Fouron J-C (2009) The underestimated potential of Doppler ultrasound to assess fetal arrhythmia: first report of a prenatal, transient, atypical atrioventricular block. Heart Rhythm 6:1226–1228. doi:10.1016/j.hrthm.2009.03.049
Oudijk MA, Gooskens RHJM, Stoutenbeek P et al (2004) Neurological outcome of children who were treated for fetal tachycardia complicated by hydrops. Ultrasound Obstet Gynecol 24:154– 158. doi:10.1002/uog.1106
RCPCH (2003) Medicines for children, 2nd edn. RCPCH Publications Limited, London
Rein AJJT (2002) Use of tissue velocity imaging in the diagnosis of fetal cardiac arrhythmias. Circulation 106:1827–1833. doi:10.1161/ 01.CIR.0000031571.92807.CC
Riggs TW, Byrd JA, Weinhouse E (1999) Recurrence risk of supraventricular tachycardia in pediatric patients. Cardiology 91:25–30
Roggen A, Pavlovic M, Pfammatter J-P (2008) Frequency of spontaneous ventricular tachycardia in a pediatric population. AJC 101: 852–854. doi:10.1016/j.amjcard.2007.10.047
Rosenthal E, Gordon PA, Simpson JM, Sharland GK (2005) Letter regarding article by Jaeggi et al, “Transplacental fetal treatment improves the outcome of prenatally diagnosed complete atrioventricular block without structural heart disease”. Circulation 111:e287–e288. doi:10.1161/01.CIR.0000164275.69617.B2, author reply e287–8
Sadovsky G, Nicolaides KH (1989) Reference ranges for fetal heart rate patterns in normoxaemic nonanaemic fetuses. Fetal Ther 4:61–68
Sanatani S, Potts JE, Reed JH et al (2012) The study of antiarrhythmic medications in infancy (SAMIS): a multicenter, randomized controlled trial comparing the efficacy and safety of digoxin versus propranolol for prophylaxis of supraventricular tachycardia in infants. Circ: Arrhythmia Electrophysiol 5:984–991. doi:10.1161/ CIRCEP.112.972620
Schwartz PJ, Salice P (1984) Cardiac arrhythmias in infancy: prevalence, significance and need for treatment. Eur Heart J 5 Suppl B:43–50
Southall DP, Johnson AM, Shinebourne EA et al (1981) Frequency and outcome of disorders of cardiac rhythm and conduction in a population of newborn infants. PEDIATRICS 68:58–66
Strasburger JF, Cheulkar B, Wakai RT (2008) Magnetocardiography for fetal arrhythmias. Heart Rhythm 5:1073–1076. doi:10.1016/j. hrthm.2008.02.035
Tan HL, Lie KI (2001) Treatment of tachyarrhythmias during pregnancy and lactation. Eur Heart J 22:458–464. doi:10.1053/euhj.2000. 2130
Vergani P,Mariani E, Ciriello E et al (2005) Fetal arrhythmias: natural history and management. UltrasoundMed Biol 31:1–6. doi:10.1016/ j.ultrasmedbio.2004.10.001
Villain E, Coastedoat-Chalumeau N, Marijon E et al (2006) Presentation and prognosis of complete atrioventricular block in childhood, according to maternal antibody status. J Am Coll Cardiol 48:1682–1687. doi:10.1016/j.jacc.2006.07.034
Walsh EP, Triedman JK, Berul CI (1992) Cardiac arrhythmias. In: Keane JF, Lock JE, Fyler DC (eds) Nadas’ pediatric cardiology, 2nd edn. Saunders Elsevier, Philadelphia, pp 377–433
Yabek SM (1991) Ventricular arrhythmias in children with an apparently normal heart. J Pediatr 119:1–11