Monitoreo hemodinámico neonatal
Enero 2023
Circulación transitional y monitoreo hemodinámico en neonatos
Aravanan Anbu Chakkarapani Pediatric Research Enero 2023
La circulación de transición normalmente
es transitoria después del nacimiento, pero puede variar notablemente entre los
bebés. Se encuentra en un estado de transición entre la circulación
fetal (in útero) y neonatal (postnatal). En ausencia de estudios clínicos
definitivos, la información de los estudios fisiológicos aplicados se puede
utilizar para facilitar la toma de decisiones clínicas en presencia de
compromiso hemodinámico. Esta revisión resume las características fisiológicas
peculiares de la circulación en su transición de un fenotipo a otro en
recién nacidos a término y prematuros. Se discuten las causas comunes de compromiso hemodinámico durante la transición, reanimación
con cordón umbilical intacto y monitoreo hemodinámico avanzado.
Impacto :
La circulación de transición puede variar notablemente entre bebés.
Hay alteraciones en la precarga, contractilidad y poscarga durante la transición de la circulación después del nacimiento en recién nacidos a término y prematuros.
Las herramientas y tecnología de monitoreo hemodinámico durante la transición neonatal y la utilización de ecocardiografía de cabecera durante la transición neonatal son cada vez más reconocidas.
Comprender la fisiología cardiovascular de la transición puede ayudar a los médicos a tomar mejores decisiones mientras manejan
recién nacidos con compromiso hemodinámico.La evaluación objetiva de la transición cardiorrespiratoria y la comprensión de la fisiología en estados normales y de enfermedad tienen el potencial de mejorar los resultados de salud a corto y largo plazo.
Introducción
Comprender los cambios fisiológicos que
ocurren durante la transición a la vida neonatal es esencial para
interpretar correctamente los problemas hemodinámicos que pueden ocurrir durante
y después de este proceso. Es un desafío para los neonatólogos manejar la
insuficiencia circulatoria durante la transición;1 los problemas pueden diferir
entre prematuros extremos recién nacidos y recién nacidos a término porque los
recién nacidos prematuros tienen una circulación inmadura,2 mientras que los
sistemas circulatorios pueden estar malformados en los recién nacidos a término.
Por lo tanto, el enfoque debe adoptarse para condiciones fisiopatológicas
específicas, tales como ductus arterioso permeable (DAP), hipotensión, hemorragia
intraventricular, asfixia al nacer, restricción severa del crecimiento e
hipertensión pulmonar a medida que la circulación cambia.3–5 Esta revisión
resume las características distintivas de la circulación transicional y
la reanimación con cordón umbilical intacto durante la transición. Algunos
conceptos más nuevos de monitoreo hemodinámico (neonatólogo realizando
ecocardiografía, espectroscopia cercana a infrarrojo (NIRS), velocimetría
eléctrica) durante la transición son también discutidos dado que se están utilizando
cada vez más al lado de la cama.
Fisiología de la circulación fetal
En el feto, la oxigenación de la sangre
ocurre en la placenta dado que los pulmones fetales están llenos de líquido
y no funcionan como un órgano de intercambio de gases.6,7 En
los humanos la vena umbilical única lleva sangre oxigenada desde la placenta a
la aurícula izquierda vía el conducto venoso,
que se une a la Vena cava inferior (VCI) cerca de la unión de la VCI con la aurícula derecha. Al
mismo tiempo, la sangre desoxigenada de la parte inferior del cuerpo fluye a
través de la VCI hacia la aurícula derecha. Interesantemente, estos dos flujos
(sangre oxigenada y desoxigenada) no se mezclan debido a la forma del conducto
venoso y la presencia de la cresta de la válvula de Eustaquio. Por lo tanto, la
mayor parte de la sangre oxigenada fluye hacia el foramen oval y entra en la
aurícula izquierda y llega al ventrículo izquierdo. Como resultado, en el feto,
el ventrículo izquierdo recibe su precarga principalmente del órgano de
intercambio de gases (placenta) como en el adulto (pulmón). La sangre
desoxigenada de la VCI se mezcla con el flujo de la vena cava superior (VCS) y entra en el ventrículo
derecho.4,8,9
En el feto, el ventrículo derecho bombea
sangre desoxigenada hacia la arteria pulmonar principal durante la sístole. Sin
embargo, debido a que la resistencia vascular pulmonar (RVP) es tan alta, la
mayor parte (~ 90 %) del flujo del ventrículo derecho (RV) no pasa por los
pulmones y entra en la circulación sistémica a través del Ductus arterioso (DA). Como la
resistencia vascular sistémica (RVS) es más baja que la RVP, debido al lecho
placentario de baja resistencia, esto también contribuye a la alta tasa de
derivación “de derecha a izquierda” a través del DA. En la aorta descendente posductal, el flujo sanguíneo
es derivado tanto del ventrículo izquierdo como del
derecho (a través del DA) y fluye hacia la parte inferior del cuerpo, incluyendo la
placenta, donde se oxigena.3,4,10 Como el ventrículo derecho proporciona la
mayor parte (> 90%) de este flujo, constituye la mayor parte del flujo al órgano
de intercambio de gases (placenta) al igual que en el adulto (pulmón). Por el contrario, el
ventrículo izquierdo proporciona la gran mayoría del flujo a la parte superior
del cuerpo, con solo ~10% del flujo del ventrículo izquierdo (VI) mezclándose
con la salida del VD y fluyendo hacia la parte inferior del cuerpo. Como
resultado, la sangre en las arterias preductales (arterias que surgen de la
aorta antes de la unión con el DA) está más oxigenada.
Fisiología de la circulación transicional
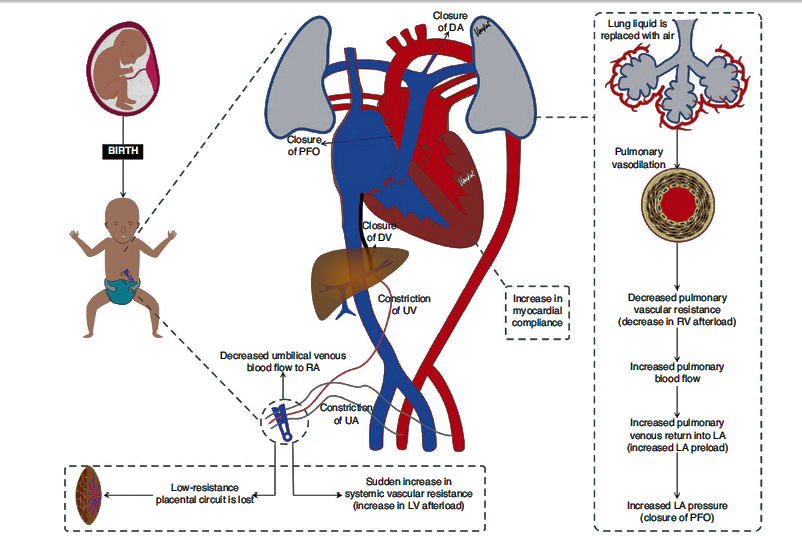
La circulación de transición (Figura 1) se
refiere al período de tiempo en que la circulación fetal se transforma en el
fenotipo neonatal.11,12 Poco después del nacimiento, esta fase comienza cuando
se pinza el cordón umbilical y los pulmones se airean después de las primeras
respiraciones. La adaptación fisiológica que sigue al parto de un recién nacido
es un proceso complejo que requiere que ocurran numerosos cambios adaptativos
simultáneamente en varios órganos. Los más significativos son los sistemas
respiratorio y cardiovascular.

Figura 1.- Características de la circulación de transición. Después del pinzamiento del cordón, la resistencia vascular sistémica aumenta, los pulmones se airean y los shunts fetales se cierran funcionalmente; la serie de cambios representados en la figura permiten la transición de la circulación fetal a la neonatal.
Inmediatamente después del
nacimiento, dos outcomes influencian si el recién nacido tendrá una transición exitosa o
no.4,10
En primer lugar, el líquido pulmonar es reemplazado por aire con el inicio de la
respiración de aire.13 Si bien el mecanismo no está claro, el movimiento de aire
hacia el pulmón es un potente vasodilatador pulmonar. El estudio de Lang et al.
demostró que un reflejo vagal puede mediar un aumento global rápido en el flujo
sanguíneo pulmonar (FSP) en respuesta a la aireación pulmonar parcial.14 Esto
provoca una gran disminución de la RVP y un aumento grande y rápido (~30 veces)
en FSP. A medida que la RVP cae rápidamente por debajo de la RVS, el shunt
a través del DA se invierte (se vuelve de izquierda a derecha) permitiendo que
el flujo VI contribuya al FSP.15,16 A través de este proceso, se
transporta más sangre desoxigenada al pulmón para su oxigenación. Las venas
pulmonares drenan la sangre oxigenada de los pulmones hacia la aurícula
izquierda, lo que luego aumenta la contribución de los pulmones a la precarga
del VI, 3,15 y los pulmones finalmente se convierten en la única fuente de esta
precarga.
En segundo lugar, con el pinzamiento del cordón umbilical, el flujo sanguíneo venoso umbilical a través del conducto venoso y el foramen oval disminuye y, por lo tanto, disminuye la precarga que ingresa al ventrículo izquierdo a través de la aurícula izquierda. El pinzamiento de la arteria umbilical también elimina el circuito de placenta de baja resistencia, lo que expone el ventrículo izquierdo del recién nacido a un repentino aumento de la RVS (aumento de poscarga del VI), lo que provoca un aumento repentino y “escalonado” de la presión arterial y del flujo sanguíneo a la parte superior del cuerpo.4,17 Para comprender los cambios que ocurren durante la transición, primero se debe tener conocimiento de la estructura y función cardiovascular en el feto.
Shunts fetales durante la circulación transicional
Poco después del nacimiento, los tres
shunts fetales pasan por una serie de cambios, como se detalla a
continuación.3,18,19
Conducto venoso
Después del pinzamiento del cordón
umbilical, el conducto venoso se vuelve ineficaz desde el punto de vista
operativo debido a la disminución del flujo sanguíneo venoso umbilical. El
conducto venoso se cierra de forma permanente dentro de las primeras 2 semanas
después del nacimiento, aunque el cierre es más lento en los recién nacidos
prematuros que en los nacidos a término.4,18,19
Foramen oval
In útero, la presión de la aurícula
derecha es más alta que la presión de la aurícula izquierda. Debido a ésto, el
foramen oval permanece abierto. Después de la aireación pulmonar, la disminución
de la RVP aumenta el flujo de la arteria pulmonar, lo que a su vez aumenta el
retorno venoso pulmonar a la aurícula izquierda. El aumento resultante en la
presión de la aurícula izquierda combinado con la pérdida de flujo dirigido
desde el conducto venoso, hace que el foramen oval se cierre y se fusione con la pared
del tabique interauricular. Este proceso hace que el foramen oval sea ineficaz
desde el punto de vista operativo poco después del nacimiento.20 El foramen oval
se cierra de forma permanente en los primeros años de vida.4,18,19
Ductus arteriosus (DA)
La mayor parte (~90 %) del gasto del
VD RV pasa de la arteria pulmonar a la aorta descendente (conocido como shunt de derecha a izquierda) a través del DA, y el flujo continúa a lo largo del
ciclo cardíaco. El flujo durante la diástole resulta del FSP retrógrado que sale
de la circulación pulmonar y atraviesa el DA debido al cierre de la válvula de
VD y
la baja RVS . Después de la aireación pulmonar, la RVP disminuye rápidamente por
debajo de la RVS , en particular después del pinzamiento del cordón umbilical, lo
que hace que el shunt a través del DA se vuelva bidireccional.
El flujo es principalmente de izquierda a derecha, pero inicialmente es de
derecha a izquierda durante la sístole temprana porque la onda de flujo que sale
del ventrículo derecho alcanza el extremo de arteria pulmonar del DA antes
de que la onda de flujo que sale del ventrículo izquierdo alcance el extremo
aórtico. Cuando el flujo que emana del ventrículo izquierdo alcanza el extremo
aórtico del DA, el flujo de DA se invierte y se vuelve de izquierda a derecha
durante la sístole tardía y durante la diástole. Si bien esta inversión del
flujo latido a latido probablemente contribuye al cierre del DA, el aumento de
la oxigenación y la reducción de los niveles de prostaglandinas circulantes
facilitan la contracción del músculo liso y, finalmente, el cierre del DA. La
RVP puede no caer de la manera habitual en los bebés prematuros debido a la
inmadurez pulmonar y en los bebés a término con hipoplasia pulmonar. Por lo
tanto, el cierre del DAP varía según la fisiopatología subyacente. Se convierte
en ligamentum arteriosum en la última parte de la vida.4,18,19
Circulación transicional en neonatos a término
En la mayoría de los recién nacidos a
término, la transición a la vida extrauterina ocurre sin problemas. Discutimos a
continuación algunas alteraciones en la precarga, contractilidad y poscarga
durante el período de transición de la circulación después del nacimiento.3,21
Cambios de precarga durante la transición
El efecto del pinzamiento del cordón umbilical sobre la precarga de los ventrículos izquierdo y derecho depende de si los pulmones se han aireado. Cuando el pinzamiento del cordón se produce antes de la aireación pulmonar y el FSP aumentado, la pérdida súbita del retorno venoso a los ventrículos izquierdo y derecho causa una reducción del gasto cardíaco que solo se restablece después de que los pulmones se airean y aumenta el FSP. Esto explica las frecuencias cardíacas bajas observadas en los nomogramas (50 % de los neonatos < 100 lpm al 1 min) de bebés sanos al nacer después del pinzamiento inmediato del cordón.22 En contraste, la aireación pulmonar antes del pinzamiento del cordón evita esta reducción en la frecuencia cardíaca dado que el aumento del FSP reemplaza la pérdida en la precarga causada por el pinzamiento del cordón. 23,24 El miocardio de los neonatos es mucho menos distensible que el de los adultos, causando disfunción diastólica parcial después del nacimiento. Como resultado, el llene pasivo de los ventrículos desde las aurículas (onda E en Doppler) es más bajo que el llenado ventricular activo mediado por la contracción auricular (onda A).25
Cambios en la contractilidad miocárdica
durante la transición
Los recién nacidos tienen menos masa miocárdica que los adultos y la organización del músculo miocárdico es diferente en los recién nacidos, la que madura gradualmente con el tiempo. El gasto cardíaco está determinado por el retorno venoso, la frecuencia cardíaca y el volumen sistólico16. Noori et al. utilizaron ecocardiografía durante el período de circulación transicional y observaron una disminución significativa (P < 0.001) de la frecuencia cardíaca (169 ± 20 latidos/min a los 3–7 min, 153 ± 17 latidos/min a los 9–14 min, 148 ± 16 latidos/min a los 15–19 min) después del nacimiento. Por el contrario, un aumento significativo (P < 0.001) del volumen sistólico del VI (1.01 ± 0.23 ml/kg/min a los 3–7 min, 1.23 ± 0.22 ml/kg/min a los 9–14 min, 1.28 ± 0.21 ml/kg/min a los 15–19 min) se observó después del nacimiento. Sin embargo, el gasto del VI no aumentó de forma significativa (P = 0.10) de 168 + 42 ml/kg/min a los 3–7 min, 186 + 26 ml/kg/min a los 9–14 min, 189 + 27 ml/kg/ min a los 15–19 min después del nacimiento. Es interesante señalar que no es probable que un aumento en el volumen sistólico del VI se deba a cambios en la contractilidad. El aumento de la precarga es el contribuyente predominante.16,26,27
Cambios en la poscarga durante la
transición
El cambio en la poscarga durante la
transición también depende de si el pinzamiento del cordón ocurre antes o
después de la aireación pulmonar. Cuando el pinzamiento del cordón ocurre antes
de la aireación pulmonar, la pérdida súbita del lecho placentario de baja
resistencia provoca un aumento escalonado y repentino (dentro de 1 s) en la RVS
y la presión arterial de ~ 30 %.23 Sin embargo, cuando la aireación pulmonar
comienza antes del pinzamiento del cordón, la gran disminución de la RVP
contribuye a una disminución general de la resistencia vascular corporal total,
lo que causa una reducción de la poscarga. Como resultado, pinzar el cordón
umbilical solo provoca un pequeño aumento en la presión arterial, ya que los
pulmones se convierten en una vía alternativa (a través del DAP) para el flujo
sanguíneo de baja resistencia para el VI. A medida que se cierra el DAP, el VI
tarda en adaptarse gradualmente al aumento de la poscarga provocado por la
pérdida de la circulación placentaria. Aunque la poscarga del VD disminuye
debido a la disminución de la RVP luego de la aireación pulmonar, las presiones
en la arteria pulmonar permanecen altas (ligeramente por debajo de las presiones
aórticas) mientras el DA permanece abierto.21 Solo cuando el DAP se
cierra y las dos circulaciones se separan funcionalmente, las presiones de arteria pulmonar pueden disminuir sustancialmente. En los recién nacidos a término,
el FO se cierra inmediatamente después del nacimiento por el aumento repentino de
la presión en aurícula izquierda (aumento del retorno venoso pulmonar), y
ésto no tiene relevancia clínica.
En general, el miocardio neonatal a término funciona de acuerdo con las
necesidades del bebé en una transición normal. Sin embargo, si la transición se
ve comprometida por cambios abruptos en la precarga o la poscarga, es posible
que el miocardio pueda no ser capaz de manejar la situación y finalmente falle. Por lo tanto,
comprender el estado del miocardio neonatal a término y el estado fisiopatológico del bebé (p. ej., encefalopatía hipóxico-isquémica [EHI],
hipertensión pulmonar) puede guiar las decisiones e intervenciones de manejo
hemodinámico basadas en los principios fisiológicos correctos.
Circulación transicional en prematuros
En los recién nacidos prematuros, es
probable que la transición a la vida extrauterina se vea comprometida por varios
factores.3,15,28–30
Resistencia vascular pulmonar
La mayoría de los prematuros nacen con pulmones inmaduros, especialmente los recién nacidos de edad gestacional extremadamente baja (ELGAN), que desarrollan síndrome de distrés respiratorio de moderado a grave. Si bien la aireación pulmonar es un estímulo potente para la disminución de la RVP, al igual que en los recién nacidos a término, el subdesarrollo del lecho vascular pulmonar limita estructuralmente el grado en que puede disminuir la RVP. Como resultado, el ventrículo derecho tiene que hacer frente a una mayor poscarga y la reducción del flujo sanguíneo de la arteria pulmonar reduce la precarga del VI y el gasto cardíaco.30–32
Resistencia vascular sistémica
Después del nacimiento, el ventrículo
izquierdo de los bebés prematuros, al igual que los bebés nacidos a término,
tiene que bombear sangre contra el aumento de la poscarga debido a la pérdida de
la circulación placentaria de baja resistencia. Sin embargo, la inmadurez del
miocardio hace que el VI sea menos capaz de hacer frente a la alta poscarga.
Combinada, la disminución de la precarga del VI con un aumento de la
poscarga del VI acentúa la disminución del gasto cardíaco del VI.30,31
Contractilidad y distensibilidad
miocárdicas
Además de la discusión en la sección
"Resistencia vascular sistémica", el miocardio prematuro tiene un mayor
contenido de agua y menos masa contráctil que los recién nacidos a término. Esto
predispone al riesgo de insuficiencia miocárdica en determinadas situaciones
como el aumento agudo de la precarga o la poscarga30,31.
Persistencia de shunts fetales
Los shunts o derivaciones fetales no se cierran en el marco de tiempo habitual en los
recién nacidos prematuros, aunque los mecanismos precisos no están claros. Sin
embargo, shunt de izquierda a derecha a través del DAP y FO es común
en los recién nacidos prematuros después del nacimiento. Este shunt de izquierda
a derecha se produce cuando la RVP es inferior a la RVS . En los bebés con DAP
hemodinámicamente significativo, hay shunts significativos del volumen de
sangre desde la aorta a la arteria pulmonar a través del DAP. Esto provoca una
disminución en el flujo de sangre hacia la aorta descendente y se manifiesta
como un flujo diastólico final ausente o revertido, lo que comúnmente se conoce
como "robo ductal". Sin embargo, el foramen oval permeable y el DAP juegan un
papel clave en la optimización de la circulación y la perfusión de órganos diana
en condiciones fisiopatológicas específicas.30,31
Monitoreo hemodinámico durante la circulación
transicional
Ecocardiografía
La ecocardiografía (Figura 2) es una
excelente herramienta de cabecera no invasiva para identificar los cambios
cardiovasculares durante la transición de la vida intrauterina a la posnatal.33
Normalmente, la adaptación cardiovascular que se produce durante la transición
ocurre sin problemas y sin ningún compromiso hemodinámico. Sin embargo, la
transición puede verse comprometida durante estados patológicos tales como asfixia perinatal, hipoplasia pulmonar grave y prematuridad. Las áreas clave en las que
concentrarse durante la ecocardiografía de cabecera para evaluar la transición
incluyen la persistencia de shunts fetales (DAP y foramen oval permeable),
presiones pulmonares y función cardíaca.25,34,35
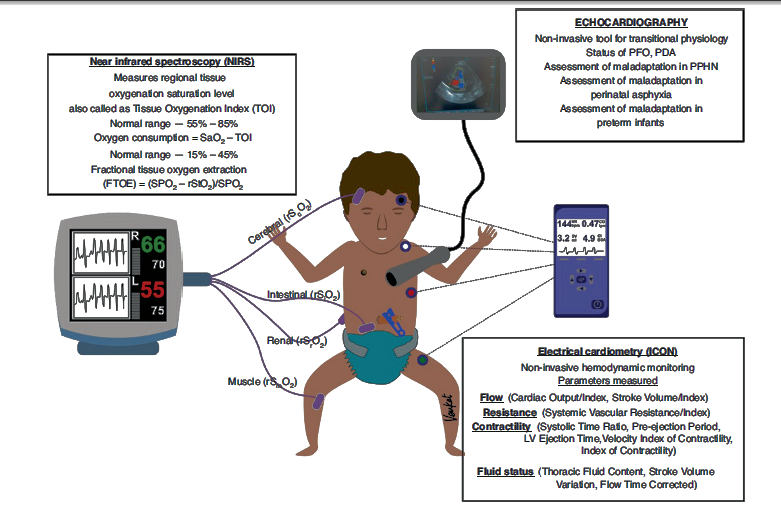
Figura 2.- Dispositivos de monitorización
hemodinámica (espectroscopia cercana a infrarrojo (NIRS), velocimetría
eléctrica (ICON), ecocardiografía).
Se describen los parámetros utilizados para la monitorización de
circulación transicional mediante NIRS, ICON y ecocardiografía.
Foramen oval persistente durante la
transición.
Poco después del nacimiento, el shunt bidireccional o de izquierda a derecha a través del foramen oval es fisiológicamente normal. Sin embargo, un shunt exclusivo de derecha a izquierda (100%) a través del foramen oval siempre debe despertar la sospecha de cardiopatías congénitas complejas subyacentes, tales como atresia tricuspídea o drenaje venoso pulmonar anómalo total.34,35
Ductus arterioso persistente (DAP) durante
transición.
Al igual que el shuint del FO permeable, el shunt bidireccional o de izquierda a derecha a través de DAP es un evento fisiológico normal. Sin embargo, después de la aireación pulmonar, un shunt persistente de derecha a izquierda durante más del 30 % del ciclo cardíaco a través del DAP debe impulsar una evaluación detallada para descartar hipertensión pulmonar persistente (HPPRN), circulación sistémica dependiente del ducuts o condiciones circulatorias pulmonares dependientes del ductus. 34,35
Evaluación ecocardiográfica de la mala
adaptación en la hipertensión pulmonar persistente
Las características de la HPPN
(hipertensión pulmonar persistente neonatal) son presiones arteriales pulmonares
elevadas causadas por una RVP alta
persistente.36 Estos parámetros son difíciles de medir mediante ecocardiografía
de cabecera35 y, por lo tanto, se utiliza comúnmente un enfoque indirecto para
evaluar la gravedad de la hipertensión pulmonar.37–39 Esto implica ecocardiografía de cabecera38 que :
Calcule la regurgitación tricuspídea (una medida indirecta de la presión sistólica de la arteria pulmonar (SPAP) o la presión sistólica del VD).
Estime la velocidad máxima de regurgitación pulmonar (presión arterial pulmonar diastólica).
Evalúe el shunt a través del DAP (en HPPN , el shunt por DAP puede ser bidireccional o 100% de derecha a izquierda), velocidad máxima de flujo transductal de derecha a izquierda (SPAP).
Calcule el índice de excentricidad sistólica del VI, evalúe el tabique interventricular (IV) y la forma del ventrículo izquierdo: el tabique IV puede estar aplanado, en forma de D y en forma de banana en el VI en HPPN.
Estime los intervalos de tiempo sistólicos del VD (tiempo de aceleración de la arteria pulmonar (PAAT), relación PAAT/RVET (tiempo de eyección del VD)).
Reconocer la hipertrofia del VD con o sin dilatación del VD.
Evaluación de la función sistólica del VD (excursión pansistólica del anillo tricuspídeo).
Calcule el cambio del área fraccional del VD para la función sistólica del VD.
Mida el gasto del VI y del VD (en HPPN, el gasto cardíaco puede estar disminuído debido a disfunción del VI y del VD).
Evalúe el shunt a través del FOP : el shunt del FOP puede ser bidireccional en HPPN.
Evaluación ecocardiográfica de malaadaptación en asfixia perinatal
La asfixia perinatal grave da como
resultado falta de oxígeno y de flujo sanguíneo al cerebro al nacer, lo que
coloca al bebé en alto riesgo de lesión cerebral hipóxico-isquémica.35 A medida
que la gravedad de la hipoxia se profundiza, la función miocárdica disminuye
gradualmente. Esta disminución contrarresta la vasodilatación de la circulación
cerebral que “salva el cerebro” combinada con la vasoconstricción de la
circulación periférica, que está diseñada para aumentar el flujo sanguíneo y el
suministro de oxígeno al cerebro y otros órganos vitales (p. ej., el
miocardio).40,41 La vasoconstricción periférica incluye la circulación pulmonar,
la que reduce la capacidad del pulmón tanto para intercambiar gases respiratorios
como para suministrar retorno venoso al ventrículo izquierdo.
La hipoxia también inhibe la actividad respiratoria creando un círculo vicioso
que requiere una intervención significativa. Inevitablemente, ésto implica VPPI
para airear los pulmones y también puede incluir compresiones torácicas y
administración de adrenalina para mejorar la función circulatoria. Luego,
durante la fase de recuperación de rebote, una circulación cerebral con máxima
vasodilatación expone la delicada microvasculatura a altas presiones y flujos,
particularmente si los mecanismos protectores de autorregulación son
disfuncionales. La hipotermia terapéutica (HT) (reducción de la temperatura
corporal central de 33,5 °C durante 72 h) es el tratamiento estándar para la EHI
moderada a grave en los países desarrollados. La HT debe comenzar dentro de las
6 h posteriores al nacimiento según criterios específicos. Además del compromiso
hemodinámico en curso debido a HIE, la HT 42,43 puede causar complicaciones
cardiovasculares en las siguientes vías.
La HT aumenta la RVP y podría provocar HPPN , lo que a su vez conduce a un aumento de la poscarga del VD y compromete la función del VD.
La HT aumenta la RVS debido a vasoconstricción periférica, lo que provoca un aumento de poscarga del VI y compromete la función del VI.
La HT provoca bradicardia e hipotensión, lo que conduce a una disminución del gasto cardíaco.
Todas las vías mencionadas conducen a una disminución del gasto cardíaco y a mala perfusión de los órganos diana. La HT tiene el potencial de comprometer la función cardíaca y la hemodinamia y causar acidemia. El objetivo del cuidado clínico en neonatos con EHI y sometidos a HT es optimizar el flujo sanguíneo de los órganos diana. La ecocardiografía de cabecera es una herramienta valiosa para monitorear los cambios hemodinámicos en tiempo real después de la asfixia perinatal. La evaluación ecocardiográfica de la precarga, función cardiaca y poscarga ayuda en la toma de decisiones clínicas en pacientes con EHI moderada a severa con compromiso hemodinámico. Por ejemplo, en neonatos con HIE que se someten a HT, el tratamiento puede orientarse objetivamente en función de la fisiopatología subyacente, tal como administrar o no un bolo de solución salina normal, seleccionar el inotrópico y monitorear la función cardíaca y la RVP para titular el tratamiento.
Evaluación ecocardiográfica de maladaptación en prematuros
Esto se ha discutido en detalle en la
sección "Monitorización hemodinámica durante la circulación de transición"28 y
debe centrarse en los siguientes puntos:
Evaluación de shunts fetales fisiológicos y su significado hemodinámico.
Evaluación de la función biventricular y correlación con la perfusión.
Valoración de presiones pulmonares en casos de síndrome de distrés respiratorio severo y ELGAN con poca oxigenación.
Evaluar la respuesta al tratamiento médico y las intervenciones para guiar el manejo.
Evaluar la interacción cardiorrespiratoria para optimizar el soporte.
Monitorización no invasiva del gasto cardíaco
En los recién nacidos, el estándar de oro
para evaluar el gasto cardíaco es la técnica de termodilución intermitente de la
arteria pulmonar o el principio de Fick. Sin embargo, ambas son técnicas
invasivas y no son adecuadas para la evaluación de rutina en la unidad
neonatal.44 Las técnicas no invasivas son la ecocardiografía transtorácica (ETT),
el monitor de gasto cardíaco por ultrasonido y la resonancia magnética cardíaca.
Estas tecnologías requieren mucho trabajo y habilidades y solo proporcionan
valores de evaluación de puntos intermitentes, y no una tendencia continua.44 La ETT se puede utilizar para estimar los
gastos ventriculares.
Una revisión cualitativa sistemática
reciente44 sobre la precisión y la capacidad de tendencia de la tecnología de biodetección eléctrica para la monitorización no invasiva del gasto cardíaco
(velocímetría eléctrica) (Figura 2) en neonatos evaluó 15 estudios.
Encontraron
que la tecnología de biodetección eléctrica torácica (TEBT) brinda una precisión
razonable, poca precisión y no intercambiabilidad en comparación con ETT, aunque
se observó un alto grado de heterogeneidad entre estos estudios, lo cual afectó
los análisis. Por lo tanto, en la actualidad, la TEBT debe usarse con cautela
para el monitoreo y la toma de decisiones clínicas en los recién nacidos en la
unidad. Sin embargo, se necesitan nuevos estudios sobre el monitoreo de
tendencias de TBET para evaluar más a fondo su uso en recién nacidos durante la
circulación de transición.
Evaluación de la perfusión de órganos
diana mediante el uso de espectroscopia de infrarrojo cercano (NIRS)
NIRS (Figura 2) es una herramienta no invasiva para medir la diferencia en la absorción de la luz
cercana al infrarrojo
por la oxihemoglobina y la desoxihemoglobina para calcular la saturación de
oxígeno tisular regional (rStO2) y la extracción fraccional de oxígeno tisular (FTOE).45,46
es una técnica de uso frecuente en Ucin y Sala de Partos que proporciona datos continuos
sobre el estado de oxigenación tisular en recién nacidos, un sustituto de la
perfusión de órganos diana. Los valores de referencia establecidos de rStO2 y
FTOE están disponibles en la literatura durante la transición para recién
nacidos a término y prematuros.47,48 En un estudio de factibilidad controlado aleatorizado (n = 30) en
neonatos < 34 semanas, Pichler et al. informó que la
monitorización NIRS puede reducir la carga de hipoxia cerebral durante la
transición y guiar el apoyo respiratorio y la oxigenoterapia suplementaria.49
Estrategias de manejo del cordón umbilical durante la
transición
Como se indicó anteriormente, cuando se
pinza el cordón umbilical en la sala de partos antes de que se haya aireado el
pulmón, la precarga del VI y el gasto cardíaco disminuyen notablemente. Esto se
debe a que la precarga del VI en el feto depende principalmente del retorno
venoso umbilical a través del conducto venoso, ya que el retorno venoso pulmonar
es bajo antes del nacimiento. Como tal, la precarga del VI permanecerá baja
hasta que el pulmón se airee y aumente el FSP. Si bien esta transición en la
fisiología circulatoria puede parecer compleja, en la práctica es sencilla para
la mayoría de los bebés a término porque comienzan a respirar y airean sus
pulmones inmediatamente después del nacimiento. Sin embargo, esta transición
hemodinámica es considerablemente más crítica en los recién nacidos prematuros y
en los recién nacidos a término comprometidos que tienen dificultad para airear
sus pulmones. Dado que mantener una precarga del VI adecuada es vital para
mantener un gasto cardíaco del VI adecuado, es lógico iniciar la aireación
pulmonar para estimular el aumento del FSP antes del pinzamiento del cordón
umbilical.50
Esto permite que el retorno venoso
pulmonar reemplace inmediatamente al retorno venoso umbilical como fuente de
precarga del VI después del pinzamiento del cordón umbilical. La pulsación del
cordón umbilical (o la falta de ella) se usa a menudo para determinar el tiempo
de pinzamiento del cordón umbilical durante el pinzamiento tardío del cordón,
pero es un predictor pobre del flujo sanguíneo en el cordón, con pulsaciones que
continúan mucho después de que el flujo ha cesado.51 El flujo sanguíneo en el
cordón umbilical continúa durante muchos minutos después del nacimiento (5 a 7 min),51 aunque esto puede variar considerablemente según el momento de la
administración del uterotónico y la tasa de aumento del FSP. Las contracciones
inducidas por uterotónicos pueden hacer que cese el flujo umbilical52 y la
disminución de la RVP redirige la salida del VD hacia los pulmones y lejos de la
placenta, lo que provoca una marcada disminución del flujo sanguíneo
umbilical.53
Una transfusión placentaria al recién
nacido puede ocurrir potencialmente hasta 5 minutos después del parto, lo que
lleva a un movimiento neto de 28 ml/kg de sangre desde la placenta hacia el
bebé. Sin embargo, esta “transfusión placentaria” aún no se ha explicado
científicamente, ya que no depende de la gravedad54 (gravedad de la
tierra) y no es causada por las
contracciones uterinas,52 aunque los cambios de presión causados por la
inspiración pueden jugar un papel.17 Sin embargo, el pinzamiento tardío del
cordón umbilical causa aumento de las reservas de hemoglobina y el
aumento del volumen sanguíneo es la única explicación factible del aumento del
peso al nacer de los lactantes que reciben un pinzamiento tardío del cordón
umbilical al nacer.
Sin embargo, como nunca se han realizado
mediciones prenatales, es posible que el trabajo de parto provoque un cambio
neto de sangre desde el bebé a la placenta (debido a un aumento en las presiones
internas del cuerpo), lo cual se desplaza hacia atrás después del nacimiento para
restablecer el equilibrio.55 Esto explicaría por qué la transfusión placentaria
no es evidente en los bebés nacidos por cesárea. En 2021, Jasani et al.56 evaluaron el efecto de cuatro
estrategias diferentes de manejo del cordón umbilical (Figura 3) para bebés
prematuros mediante la realización de una revisión sistemática y un metanálisis
en red de 6852 bebés prematuros enrolados en 56 estudios.
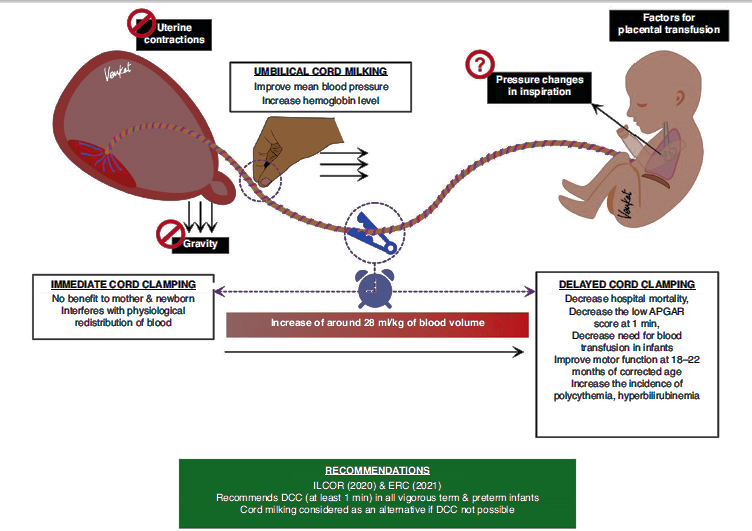
Figura 3.- Estrategias de manejo del cordón. Se describen las limitaciones del pinzamiento inmediato del cordón y los beneficios del pinzamiento tardío y el ordeño (milking) del cordón.
Pinzamiento inmediato del cordón umbilical (ICC).
Pinzamiento retrasado del cordón umbilical (DCC).
Ordeño de cordón umbilical (UCM o milking).
UCM y DCC.
Este análisis mostró que DCC se asoció con
menores probabilidades de mortalidad en recién nacidos prematuros en comparación
con ICC. DCC y UCM se relacionaron con reducciones en la hemorragia
intraventricular y la necesidad de transfusión de glóbulos rojos en comparación
con ICC. No se encontraron diferencias significativas entre UCM y DCC para
ningún outcome en neonatos de más de 29 semanas de gestación. Sin embargo,
más recientemente, se descubrió que la UCM en bebés extremadamente prematuros
aumenta 4 veces el riesgo de Hiv grave y, como tal, no se recomienda para bebés
prematuros < 28 semanas.57
Consenso internacional sobre manejo del cordón umbilical
La guía de consenso para Nals (neonatal advance life support) sobre recomendaciones científicas y de tratamiento (CoSTR) del Comité de Enlace Internacional sobre reanimación (ILCOR o International Liaison Committee on Resuscitation ) del 2020 aboga por DCC (durante al menos 1 min) en recién nacidos a término y prematuros sin problemas.58,59
La guía 2021 del Consejo Europeo de Resucitación (ERC) sobre la reanimación de recién nacidos y el apoyo de transición de los bebés al nacer recomienda60 el pinzamiento diferido del cordón (DCC) durante al menos 60 s, idealmente después de que se aireen los pulmones. El ordeño del cordón se debe considerar como una alternativa razonable si la DCC no es posible en bebés de más de 28 semanas de gestación.
Manejo del cordón umbilical en hernia diafragmática congénita (HDC)
La literatura sobre la adaptación
fisiológica de los bebés con HDC durante la transición es escasa,61 pero están
surgiendo algunos estudios científicos. La aireación pulmonar no ocurre
rápidamente en recién nacidos con HDC porque los pulmones son pequeños y los
efectos intratorácicos de los órganos abdominales herniados ocupan espacio. Tres
componentes de la HDC son (1) hipoplasia pulmonar, (2) hipertensión pulmonar y
(3) disfunción cardíaca. Además de un pulmón pequeño con un área de superficie
de intercambio de gases limitada, los bebés con HDC también tienen un lecho
vascular pulmonar subdesarrollado con un área de sección transversal pequeña.
Como tal, los bebés con HDC enfrentan importantes desafíos hemodinámicos durante
la transición y tienen un alto riesgo de desarrollar hipertensión pulmonar y
disfunción cardíaca (disfunción del VI, disfunción del VD o
disfunción biventricular).
El enfoque estándar en la sala de partos es pinzar inmediatamente el cordón
umbilical seguido de intubación en la mesa de reanimación. Sin embargo, los
estudios en corderos con HDC e hipoplasia pulmonar grave han demostrado que
ventilarlos durante hasta 10 minutos "en el cordón" (cordón umbilical intacto)
da como resultado una RVP notablemente más baja y un FSP más alta hasta 2 h
después del nacimiento en comparación con los corderos que tienen pinzamiento
inmediato del cordón. Foglia et al.62 realizaron un estudio piloto de un solo
sitio (20 bebés), seguridad y viabilidad de iniciar la reanimación mediante
intubación y ventilación antes del pinzamiento del cordón umbilical en bebés con
HDC de > 36 semanas de edad gestacional con la ayuda de un carro. El equipo de
estudio pudo colocar al 100 % de los bebés en el carro para reanimación e
intubar al 85 % de los bebés antes de UCC. Actualmente, se está realizando un
ensayo controlado aleatorio multicéntrico de alta calidad que examina los
beneficios de PBCC, que implica ventilar a los bebés con el cordón umbilical
intacto
Dispositivos utilizados para reanimación
con cordón umbilical intacto para establecer ventilacón durante circulación
transicional en sala de parto
Los autores de ILCOR y ERC recomiendan actualmente cortar el cordón umbilical e iniciar medidas estándar de reanimación en bebés que no respiran. La reanimación con cordón umbilical intacto para establecer la ventilación antes del pinzamiento del cordón para bebés comprometidos al nacer está actualmente en prueba y, por lo tanto, aún no se recomienda para uso de rutina.50,63–65 Para abordar este problema en detalle, necesitamos una plataforma que apoye el inicio de reanimación (establecimiento de la ventilación) con un cordón umbilical intacto mientras la circulación fetoplacentaria permanece intacta. Esta plataforma debe acomodar el equipo esencial requerido para la reanimación, ser estable para que se puedan realizar las acciones requeridas, proporcionar una fuente de calor externa para el bebé y poder colocarse cerca de la madre para que el cordón umbilical esté no estirado.
Necesitamos más estudios para evaluar los beneficios de este enfoque en los partos prematuros de alto riesgo que deberían proporcionar más información a los médicos sobre los beneficios potenciales. Sin embargo, al usar estos dispositivos, se debe tener en cuenta cómo se colocará la plataforma en la sala de partos y la posición de los proveedores de atención (obstetras, neonatólogos, anestesiólogos y matronas) alrededor de la plataforma o carro durante la reanimación en partos vaginales y por cesárea. . Esto puede incluir la "limpieza" de los neonatólogos y la esterilización del equipo de reanimación durante los partos por cesárea para mantener un campo estéril mientras se estabiliza o reanima al bebé con el cordón umbilical, como ocurrió en los ensayos ABC y BabyDUCC.24,66
Conclusión
Después del nacimiento, los cambios cardiopulmonares significativos ocurren
gradualmente de manera secuencial, pasando del fenotipo circulatorio fetal,
a través de un fenotipo de circulación de transición, hasta finalmente la
circulación neonatal/adulta definitiva. Durante la transición, las áreas clave
en las que centrarse para la circulación son el mantenimiento de precarga
después del pinzamiento del cordón, contractilidad cardíaca (función
sistólica), reducción al mínimo del aumento de poscarga, aumento de la distensibilidad miocárdica (función diastólica) y la reducción al mínimo de la
persistencia de shunts fetales. Además, se requieren con urgencia
estudios que evalúen la perfusión de órganos finales y la oximetría cerebral
durante la transición neonatal. La inmadurez del sistema circulatorio en los
recién nacidos prematuros aumenta el compromiso hemodinámico durante la
transición. Necesitamos más estudios fisiológicos con tecnologías avanzadas de
monitoreo hemodinámico para comprender los cambios que ocurren durante la
transición y durante la ventilación con reanimación con cordón umbilical
intacto para mejorar los resultados para los recién nacidos durante este período
crucial. Comprender la fisiología cardiovascular de la transición puede ayudar a
los médicos a tomar mejores decisiones al tratar a los bebés con compromiso hemodinámico.
Referencias
Mahoney, L. T., Coryell, K. G. & Lauer, R. M. The newborn transitional circulation: a two-dimensional Doppler echocardiographic study. J. Am. Coll. Cardiol. 6, 623–629 (1985).
Siassi, B. Normal and abnormal transitional circulation in the IUGR infant. Semin. Perinatol. 12, 80–83 (1988).
Sansoucie, D. A. & Cavaliere, T. A. Transition from fetal to extrauterine circulation. Neonatal Netw. 16, 5–12 (1997).
Blackburn, S. Placental, fetal, and transitional circulation revisited. J. Perinat. Neonatal Nurs. 20, 290–294 (2006).
Hooper, S. B., Siew, M. L., Kitchen, M. J. & te Pas, A. B. Establishing functional residual capacity in the non-breathing infant. Semin. Fetal Neonatal Med. 18, 336–343 (2013).
Mattos, S. S. [Fetal circulation physiology and diagnosis of functional alterations of the fetal heart]. Arq. Bras. Cardiol. 69, 205–207 (1997).
Remien, K. & Majmundar, S. H. in Physiology, Fetal Circulation, (StatPearls Publishing LLC, 2022).
Heymann, M. A. Control of the pulmonary circulation in the fetus and during the transitional period to air breathing. Eur. J. Obstet. Gynecol. Reprod. Biol. 84, 127–132 (1999).
Kiserud, T. Physiology of the fetal circulation. Semin. Fetal Neonatal Med. 10, 493–503 (2005).
Finnemore, A. & Groves, A. Physiology of the fetal and transitional circulation. Semin. Fetal Neonatal Med. 20, 210–216 (2015).
Clarke, W. R. The transitional circulation: physiology and anesthetic implications. J. Clin. Anesth. 2, 192–211 (1990).
Matthews, M. Anatomy and physiology of the fetal and neonatal circulation. Radiography 44, 9–13 (1978).
te Pas, A. B., Davis, P. G., Hooper, S. B. & Morley, C. J. From liquid to air: breathing after birth. J. Pediatr. 152, 607–611 (2008).
Lang, J. A. et al. Vagal denervation inhibits the increase in pulmonary blood flow during partial lung aeration at birth. J. Physiol. 595, 1593–1606 (2017).
Hooper, S. B., Polglase, G. R. & Roehr, C. C. Cardiopulmonary changes with aeration of the newborn lung. Paediatr. Respir. Rev. 16, 147–150 (2015).
van Vonderen, J. J. et al. Measuring physiological changes during the transition to life after birth. Neonatology 105, 230–242 (2014).
Brouwer, E. et al. Effect of breathing on venous return during delayed cord clamping: an observational study. Arch. Dis. Child Fetal Neonatal Ed. 107, 65–69 (2022).
Leshen, M. A., Devanagondi, R., Saul, D. & Chaturvedi, A. Physiological fetal vascular shunts and failure to regress: what the radiologist needs to know. Pediatr. Radiol. 52, 1207–1223. https://doi.org/10.1007/s00247-022-05302-0 (2022).
Zampieri, F., Thiene, G., Basso, C. & Zanatta, A. The three fetal shunts: a story of wrong eponyms. J. Anat. 238, 1028–1035 (2021).
Evans, N. & Iyer, P. Incompetence of the foramen ovale in preterm infants supported by mechanical ventilation. J. Pediatr. 125, 786–792 (1994).
Hu, Q. et al. Changes in pulmonary artery pressure during early transitional circulation in healthy full-term newborns. Ultrasonics 56, 524–529 (2015).
Dawson, J. A. et al. Changes in heart rate in the first minutes after birth. Arch. Dis. Child Fetal Neonatal Ed. 95, F177–F181 (2010).
Bhatt, S. et al. Delaying cord clamping until ventilation onset improves cardiovascular function at birth in preterm lambs. J. Physiol. 591, 2113–2126 (2013).
Blank, D. A. et al. Baby-directed umbilical cord clamping: a feasibility study. Resuscitation 131, 1–7 (2018).
Popat, H. & Kluckow, M. Noninvasive assessment of the early transitional circulation in healthy term infants. Neonatology 101, 166–171 (2012).
Noori, S. et al. Transitional changes in cardiac and cerebral hemodynamics in term neonates at birth. J. Pediatr. 160, 943–948 (2012).
Winberg, P., Jansson, M., Marions, L. & Lundell, B. P. Left ventricular output during postnatal circulatory adaptation in healthy infants born at full term. Arch. Dis. Child 64, 1374–1378 (1989).
Finn, D., Boylan, G. B., Ryan, C. A. &
Dempsey, E. M. Enhanced monitoring of the preterm infant during
stabilization in the delivery room. Front. Pediatr. 4, 30
(2016).
Kluckow, M. Low systemic blood flow and pathophysiology of the preterm transitional circulation. Early Hum. Dev. 81, 429–437 (2005).
Gupta, S. & Donn, S. M. Hemodynamic management of the micropreemie: when inotropes are not enough. Semin. Fetal Neonatal Med. 27, 101329 (2022).
Wu, T. W., Azhibekov, T. & Seri, I. Transitional hemodynamics in preterm neonates: clinical relevance. Pediatr. Neonatol. 57, 7–18 (2016).
Lakkundi, A., Wright, I. & de Waal, K.
Transitional hemodynamics in preterm infants with a respiratory management
strategy directed at avoidance of
mechanical ventilation. Early Hum. Dev. 90, 409–412 (2014).
Alenick, D. S., Holzman, I. R. & Ritter, S. B. The neonatal transitional circulation: a combined noninvasive assessment. Echocardiography 9, 29–37 (1992).
Singh, Y. & Tissot, C. Corrigendum: echocardiographic evaluation of transitional circulation for the neonatologists. Front. Pediatr. 8, 600496 (2020).
Singh, Y. & Tissot, C. Echocardiographic evaluation of transitional circulation for the neonatologists. Front. Pediatr. 6, 140 (2018).
Lakshminrusimha, S. The pulmonary circulation in neonatal respiratory failure. Clin. Perinatol. 39, 655–683 (2012).
Butt, M. U. et al. Predicting the severity and outcome of persistent pulmonary hypertension of the newborn using new echocardiography parameters. Curr. Probl. Cardiol. 101181 (2022).
de Boode, W. P. et al. Application of neonatologist performed echocardiography in the assessment and management of persistent pulmonary hypertension of the newborn. Pediatr. Res. 84, 68–77 (2018).
Valdes-Cruz, L. M., Dudell, G. G. & Ferrara, A. Utility of M-mode echocardiography for early identification of infants with persistent pulmonary hypertension of the newborn. Pediatrics 68, 515–525 (1981).
Sehgal, A. et al. Impact of acute and
chronic hypoxia-ischemia on the transitional circulation. Pediatrics 147,
e2020016972. https://doi.org/10.1542/peds.2020-
016972 (2021).
Liu, J., Li, J. & Gu, M. The
correlation between myocardial function and cerebral hemodynamics in term
infants with hypoxic-ischemic encephalopathy. J. Trop.
Pediatr. 53, 44–48 (2007).
Yoon, J. H. et al. Impacts of
therapeutic hypothermia on cardiovascular hemodynamics in newborns with
hypoxic-ischemic encephalopathy: a case control
study using echocardiography. J. Matern. Fetal Neonatal Med. 31, 2175–2182
(2018).
Gebauer, C. M., Knuepfer, M., Robel-Tillig, E., Pulzer, F. & Vogtmann, C. Hemodynamics among neonates with hypoxic-ischemic encephalopathy during wholebody hypothermia and passive rewarming. Pediatrics 117, 843–850 (2006).
Van Wyk, L., Gupta, S., Lawrenson, J. & de Boode, W. P. Accuracy and trending ability of electrical biosensing technology for non-invasive cardiac output monitoring in neonates: a systematic qualitative review. Front. Pediatr. 10, 851850 (2022).
Viaroli, F. et al. Reducing brain injury of preterm infants in the delivery room. Front. Pediatr. 6, 290 (2018).
Dix, L. M., van Bel, F. & Lemmers, P. M. Monitoring cerebral oxygenation in neonates: an update. Front. Pediatr. 5, 46 (2017).
Pichler, G. et al. Reference ranges
for regional cerebral tissue oxygen saturation and fractional oxygen
extraction in neonates during immediate transition after
birth. J. Pediatr. 163, 1558–1563 (2013).
Baik, N. et al. Reference ranges for cerebral tissue oxygen saturation index in term neonates during immediate neonatal transition after birth. Neonatology 108, 283–286 (2015).
Pichler, G. et al. Cerebral oxygen saturation to guide oxygen delivery in preterm neonates for the immediate transition after birth: a 2-center randomized controlled pilot feasibility trial. J. Pediatr. 170, 73–78.e71–74 (2016).
Andersson, O. et al. Intact cord resuscitation versus early cord clamping in the treatment of depressed newborn infants during the first 10 min of birth (Nepcord III) - a randomized clinical trial. Matern. Health Neonatol. Perinatol. 5, 15 (2019).
Boere, I. et al. Umbilical blood flow patterns directly after birth before delayed cord clamping. Arch. Dis. Child Fetal Neonatal Ed. 100, F121–F125 (2015).
Stenning, F. J. et al. Effect of maternal oxytocin on umbilical venous and arterial blood flows during physiological-based cord clamping in preterm lambs. PLoS One 16, e0253306 (2021).
Blank, D. A. et al. Haemodynamic
effects of umbilical cord milking in premature sheep during the neonatal
transition. Arch. Dis. Child Fetal Neonatal Ed. 103,
F539–F546 (2018).
Hooper, S. B. et al. Effect of body position and ventilation on umbilical artery and venous blood flows during delayed umbilical cord clamping in preterm lambs. Arch. Dis. Child Fetal Neonatal Ed. 102, F312–F319 (2017).
Hooper, S. B. et al. Cardiovascular transition at birth: a physiological sequence. Pediatr. Res. 77, 608–614 (2015).
Jasani, B., Torgalkar, R., Ye, X. Y., Syed, S. & Shah, P. S. Association of umbilical cord management strategies with outcomes of preterm infants: a systematic review and network meta-analysis. JAMA Pediatr. 175, e210102 (2021).
Katheria, A. et al. Association of
umbilical cord milking vs delayed umbilical cord clamping with death or
severe intraventricular hemorrhage among preterm
infants. JAMA 322, 1877–1886 (2019).
Wyckoff, M. H. et al. Neonatal Life
Support 2020 International Consensus on cardiopulmonary resuscitation and
emergency cardiovascular care science with
treatment recommendations. Resuscitation 156, A156–A187 (2020).
Wyckoff, M. H. et al. Neonatal Life
Support: 2020 International Consensus on cardiopulmonary resuscitation and
emergency cardiovascular care science with
treatment recommendations. Circulation 142, S185–S221 (2020).
Madar, J. et al. European
Resuscitation Council Guidelines 2021: newborn resuscitation and support of
transition of infants at birth. Resuscitation 161,
291–326 (2021).
Lefebvre, C. et al. Feasibility and safety of intact cord resuscitation in newborn infants with congenital diaphragmatic hernia (CDH). Resuscitation 120, 20–25 (2017).
Foglia, E. E. et al. Initiating resuscitation before umbilical cord clamping in infants with congenital diaphragmatic hernia: a pilot feasibility trial. Arch. Dis. Child Fetal Neonatal Ed. 105, 322–326 (2020).
Katheria, A. C. Neonatal resuscitation with an intact cord: current and ongoing trials. Children (Basel) 6, 60. https://doi.org/10.3390/children6040060 (2019).
Pratesi, S. et al. Placental Circulation Intact Trial (PCI-T)-resuscitation with the placental circulation intact vs. cord milking for very preterm infants: a feasibility study. Front Pediatr. 6, 364 (2018).
Katheria, A., Lee, H. C., Knol, R., Irvine, L. & Thomas, S. A review of different resuscitation platforms during delayed cord clamping. J. Perinatol. 41, 1540–1548 (2021).
Knol, R. et al. Physiological-based
cord clamping in very preterm infants – randomised controlled trial on
effectiveness of stabilisation. Resuscitation 147, 26–33 (2020).