
Shock séptico neonatal
Enero 2022
Shock séptico neonatal, un enfoque en las intervenciones de primera línea
Spaggiari Valentina
Acta Biomed 2022; Vol. 93, N. 3: e2022141
Introducción
La sepsis es una disfunción orgánica
potencialmente mortal debido a una respuesta desregulada del huésped a la
infección. La sepsis neonatal se clasifica en sepsis de inicio precoz (EOS) y
sepsis de inicio tardío (LOS) definida como un hemocultivo o cultivo de líquido
cefalorraquídeo positivo obtenido dentro de los 3 días de edad o más,
respectivamente. (1) Los recién nacidos antes de las 28 semanas de
gestación o con un peso al nacer inferior a 1500 g son particularmente
susceptibles a la sepsis. (2-5) Las tasas de mortalidad asociadas a
la sepsis varían según la gravedad de los síntomas clínicos, factores de riesgo,
ubicación geográfica. Dos estudios italianos recientes basados en áreas
mostraron que la mortalidad también estaba estrictamente asociada con una edad
gestacional baja (EOS: OR 0.71 [0.60-0.83]; LOS: OR 2.3 [1.2-4.7]) o la
necesidad de apoyo con catecolaminas para el tratamiento de shock séptico. (EOS:
OR 21.3 [6.58-68]; LOS: OR
12.6 [1.6-101.9]). (6,7)
Los patógenos involucrados en shock séptico pueden variar según la edad
neonatal, sitio de infección y enfermedades subyacentes preexistentes.
(8,9) Los principales patógenos que causan EOS son las bacterias que
colonizan el tracto genital materno, es decir, el estreptococo del grupo B (GBS),
Escherichia coli y Listeria monocitogenes. (7,10,11) Los patógenos
pueden transmitirse durante el trabajo de parto o después de la ruptura de
membrana. En algunos países de ingresos altos que utilizan ampliamente la
profilaxis antibiótica intraparto para prevenir el estreptococo del grupo B, E.
coli es ahora el primer patógeno en EOS. (10,12,13) La LOS se debe
más comúnmente a patógenos Gram positivos (estafilococos coagulasa negativos, S.
aureus, GBS) o Gram negativos (E. Coli, Enterobacteriacee, Pseudomonas
aeruginosa). (7,14,15) Los CONS son los patógenos nosocomiales más
comunes que causan LOS, mientras que Candida albicans es el principal patógeno
entre los hongos en los recién nacidos con MBPN y LOS. (1)
Por el contrario, algunos patógenos
pueden adquirirse más comúnmente en la comunidad. (7) El estreptococo
del grupo B de inicio tardío a menudo se adquiere de fuentes maternas, ya sea en
el parto o en el posparto, después del alta de la sala de recién nacidos. Los
patógenos también se pueden adquirir de fuentes no maternas. La estadía
hospitalaria prolongada en la Unidad de Cuidados Intensivos Neonatales (UCIN) y
el uso de antibióticos de amplio espectro aumentan el riesgo de colonización
neonatal con patógenos resistentes a múltiples fármacos, (16,17) y
los recién nacidos ingresados en la UCIN pueden sufrir uno o más episodios de
LOS durante su hospitalización . (7) Esta revisión se centra en las
intervenciones iniciales para el tratamiento del shock séptico. Estas
intervenciones mejoran el outcome neonatal cuando se llevan a cabo con
prontitud.
Definición de sepsis y shock séptico
El shock es una hipoperfusión tisular
generalizada que se establece rápidamente. El shock es el resultado de múltiples
mecanismos relacionados que conducen a un deterioro celular grave debido a un
desequilibrio entre la nutrición celular y la eliminación de metabolitos
tóxicos. (18) La definición de sepsis y shock séptico en la edad
pediátrica es controvertida.
Wynn sugirió tres definiciones diferentes y posteriormente las adaptó a los
recién nacidos prematuros. (3,4,19,20) Estas definiciones reconocen
tres
fases subsiguientes : síndrome de respuesta inflamatoria sistémica (SIRS) ,
sepsis y shock séptico. Sin embargo, estas definiciones de sepsis pediátrica
tienen un valor limitado para los médicos de cabecera para identificar casos de
sepsis, ya que tienen un valor predictivo bajo y no han sido validadas.
(21,22) Recientemente, la definición de sepsis en adultos ha sido
actualizada destacando el rol central del deterioro de órganos; el shock séptico
ocurre en un subgrupo de pacientes con sepsis en los cuales el deterioro
circulatorio, celular o metabólico es lo suficientemente profundo como para
aumentar el riesgo de mortalidad. (23)
Durante las primeras semanas de vida, los órganos están inmaduros y se producen
cambios fisiológicos en las funciones de los sistemas vitales. En consecuencia,
los valores de referencia y las variaciones de la norma de algunos parámetros
vitales no están bien definidas. Por lo tanto, el concepto de disfunción
orgánica como criterio diagnóstico es infrecuentemente utilizado en neonatos.
(20) Se requieren más estudios para evaluar criterios para neonatos,
posiblemente adaptando los establecidos en población adulta. (24)
Fisiopatología
Una vez que el patógeno ha entrado en
el organismo, los monocitos y macrófagos reconocen las moléculas expresadas (PAMPS:
patrones moleculares asociados a patógenos) a través de receptores de
superficie, incluyendo los TLR (Toll Like Receptors). Como consecuencia, esta
interacción genera la activación de segundos mensajeros y cascadas que causan
liberación de citoquinas y quimioquinas que amplifican la respuesta inmune (INFγ,
IL1β, IL6, IL8, IL12, IL18, MCP, MIP, TNFα) y activan el endotelio. Otros
receptores involucrados son los receptores intracitoplasmáticos (receptores tipo
NOD [NLR], receptores tipo RIG [RLR]); tienen un papel en la creación del
inflamasoma, contribuyendo a la activación de la función linfocitaria y del
complemento, especialmente del receptor CR3. En los recién nacidos a término, en
el primer mes de vida, una expresión reducida del receptor CR3 y L-selectina
predispone al riesgo de sepsis.
Si la infección y la inflamación no se controlan, un estado inflamatorio
endotelial generalizado puede causar shock séptico. El daño y activación
generalizada del endotelio, asociado a la diseminación sistémica del patógeno,
provoca daño a la microcirculación con hipoxia tisular, acidosis e hipotensión.
(18,25) Paralelamente al estado inflamatorio, el organismo también
produce una serie de moléculas antiinflamatorias (TNF2, receptor de IL6,
antagonista del receptor de IL1) con el fin de atenuar la intensidad de la
respuesta inflamatoria sistémica. Con el mismo fin se produce un aumento del
cortisol endógeno. Los recién nacidos prematuros tienen una insuficiencia
suprarrenal relativa que contribuye a inestabilidad hemodinámica e hipotensión.
(3)
Aspectos clínicos del shock séptico
La sepsis puede presentarse con
síntomas inespecíficos (taquicardia, problemas respiratorios, mala alimentación,
hipotonía, letargo, piel pálida o cianótica, disminución de diuresis), que puede
evolucionar rápidamente a shock séptico. El diagnóstico rápido es un desafío, ya
que la sepsis neonatal puede superponerse con los cambios fisiológicos que
ocurren al nacer. Estos cambios pueden afectar el curso normal de la adaptación
neonatal y complicar este equilibrio precario, lo que dificulta la evaluación de
la carga del compromiso orgánico asociado con el shock séptico. (2)
El shock séptico puede progresar a través de tres fases consecutivas, que van
desde compensado hasta no compensado. Cada una de estas fases tiene mecanismos
compensatorios neuroendocrinos y signos clínicos específicos (tabla
1). (3,6)
Tabla 1.- Mecanismos compensatorios neuroendocrinos y signos clínicos de shock séptico

Además, el shock séptico se distingue en caliente y frío. La
Tabla 2
muestra los cambios hemodinámicos y las presentaciones clínicas durante el shock
séptico caliente y frío.
Tabla 2.- Cambios hemodinámicos y presentaciones clínicas durante shock caliente y frío
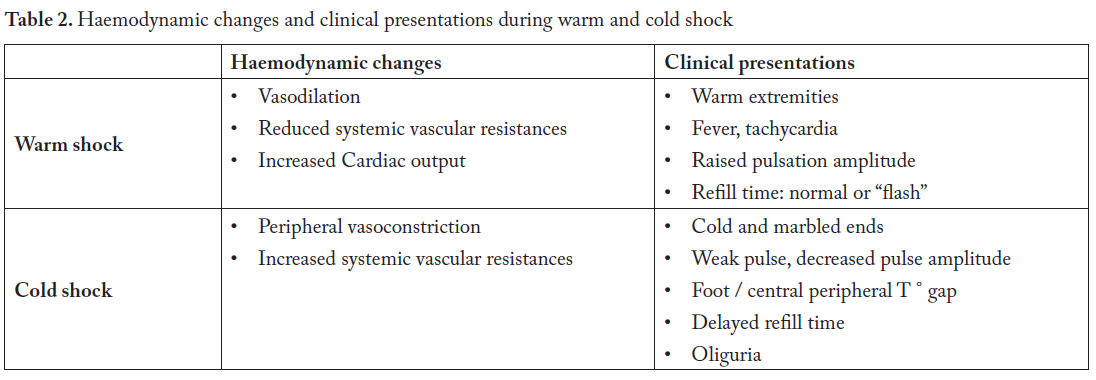
En el shock caliente prevalece inicialmente la vasodilatación con resistencias vasculares disminuídas, mientras aumenta el gasto cardíaco. Durante el shock frío
subsiguiente, la compensación cardíaca falla, mientras que las resistencias vasculares aumentan debido a vasoconstricción.
En adultos, el shock séptico generalmente
se presenta con disfunción miocárdica y fracción de eyección cardíaca
disminuida. Por el contrario, en la edad pediátrica predomina la hipovolemia
grave , como lo demuestra la mejoría observada trás la sobrecarga de volumen.
(3) El miocardio neonatal no es capaz de compensar las necesidades
aumentadas a través de un aumento en el volumen de eyección (que es
relativamente fijo, debido al pequeño tamaño ventricular y la reducción de la
distensibilidad), ni con un aumento sostenido en la frecuencia cardíaca, que ya
es alta. La taquicardia persistente también empeora la perfusión del propio
miocardio que se produce durante la diástole y el consumo de O2 miocárdico, con
riesgo de isquemia. (3)
La sepsis causa acidosis metabólica e hipoxia con el consiguiente aumento de las
resistencias pulmonares y persistencia de la circulación fetal, caracterizada
por cortocircuitos intra y extracardiacos de derecha a izquierda. El aumento de
las resistencias vasculares pulmonares y su persistencia causan insuficiencia
ventricular derecha que afecta la función ventricular izquierda.
En el recién nacido, también es importante distinguir el shock séptico del cardiogénico debido a cierre del ductus arterial en las cardiopatías congénitas ductus-dependientes complejas. El tratamiento con prostaglandinas debe iniciarse de inmediato en todo neonato con shock y hepatomegalia, cianosis, soplo cardíaco, diferencia de presión arterial y/o pulsos periféricos entre miembros superiores e inferiores.
El tratamiento con prostaglandinas debe suspenderse una vez descartadas las cardiopatías ductus-dependientes. Las primeras fases de los errores metabólicos congénitos también pueden simular shock séptico. (20)
Terapia
El outcome del shock séptico depende
de un reconocimiento rápido de los síntomas que sugieren sepsis y una estricta
adherencia a las guías, protocolos y algoritmos de reanimación cardiopulmonar de
acuerdo con las guías PALS. (27, 28, 29) El outcome también varía
según la oportunidad en que se alcancen los 3 objetivos siguientes :
a) Recuperación del shock, demostrada por la normalización tanto del tiempo de
llenado capilar (< 3”) como de la presión arterial; b) Infusión de
antimicrobianos de amplio espectro y c) Infusión de líquidos (cristaloides)
dentro de 1 hora desde el inicio de los síntomas. (30) La
figura 1
muestra los pasos iniciales en el tratamiento del shock séptico en el recién
nacido.
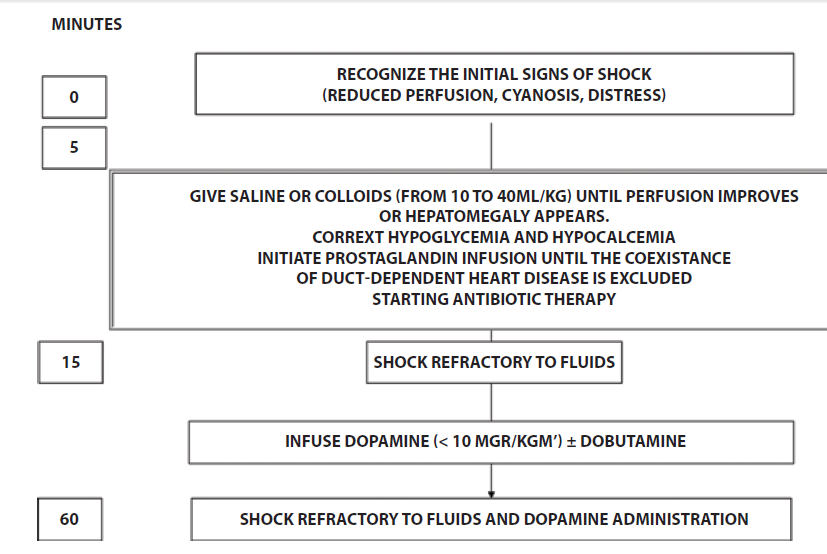
Figura 1.- Pasos iniciales en el tratamiento del choque séptico en el recién nacido (modificado de Referencia 30)
La administración de líquidos juega un
papel importante en el manejo inicial del shock séptico. La administración de
coloides (5% de albúmina) sigue siendo controvertida, (31,32,33)
mientras que los cristaloides (solución salina para neonatos, Ringer Lactato o
solución salina para niños) suelen ser los fluidos de primera línea. Un estudio
observacional prospectivo enroló 49.153 niños (menores de 18 años) con sepsis
grave. El estudio se llevó a cabo en 43 hospitales de EE. UU. entre 2004 y 2012.
Entre 36.908 niños que fueron analizados para reanimación con líquidos, 2.398
(mediana de edad 3.2 años) recibieron solo cristaloides balanceados (es decir,
ringer lactato) y 30.166 (mediana de edad 5.8 años) recibieron solo fluidos
desbalanceados. Las tasas de mortalidad disminuyeron (12.5 % versus 15.9 %; p =
0.007, OR 0.76; 95 %, IC 0.62-0.93) cuando se administraron líquidos
equilibrados en lugar de solución salina. Además, el autor sugirió evitar la
sobrecarga de líquidos, ya que se asoció con peores outcomes. (32)
Se llevó a cabo un estudio de cohorte
retrospectivo en 12.529 niños (menores de 18 años) con sepsis grave o shock
séptico en 382 hospitales de EE. UU. (de 2000 a 2013). Se administró ringer lactato y solución
salina a 2.150 y 10.379 niños respectivamente. Se seleccionó una
muestra de 2.117 niños de cada grupo (mediana de edad de 8 y 7 años para la
infusión de Ringer lactato y solución salina, respectivamente). No se
encontraron diferencias en la mortalidad entre los grupos (RR 0.99, 95%, IC
0.98, 1.01, p = 0.2). (31)
Además, la duración de la infusión de
líquidos EV también es controvertida. Sankar enroló a 96 niños menores de 18
años que recibieron bolos de líquidos con solución salina normal. Los bolos de líquidos
se administraron en 45 niños (mediana de edad 6.5 años) dentro de 15-20
minutos y en 51 niños (mediana de edad 6 años) dentro de 5-10 minutos. La ventilación mecánica o el aumento del
índice de oxigenación después de la reanimación con líquidos fueron menos
frecuentes entre los niños que recibieron bolos de líquidos dentro de 15 a
20 minutos en las primeras 6 horas (36 % versus 57 %; riesgo relativo, 0.62; IC 95 %, 0.39–0.99) y 24 horas de
shock séptico (43 vs. 68 %; riesgo relativo,
0.63; IC 95 %, 0.42–0.93). Este estudio respalda una mayor duración de los bolos
de líquidos y un cambio en la práctica actual, (34) aunque, releídos
críticamente por otros, estos datos llevaron a conclusiones opuestas, a saber,
que los líquidos deben administrarse dentro de 10 minutos. (35) Es
preferible utilizar una vía venosa central; sin embargo, en condiciones de
emergencia, se puede utilizar un acceso intraóseo (si el peso corporal es
superior a 3 kg) o un acceso venoso periférico. En el recién nacido se puede
insertar el acceso venoso umbilical hasta 15 días de vida. (30)
Los fluidos (generalmente solución salina
en neonatos) deben administrarse con precaución en neonatos, especialmente en
bebés prematuros con conducto arterioso permeable persistente, debido a los
riesgos de insuficiencia cardíaca congestiva, edema pulmonar o reapertura de un
ductus arterioso previamente cerrado. Además, la administración abundante y
rápida de líquidos en recién nacidos prematuros puede provocar hemorragia intraventricular, mientras que la hipoperfusión cerebral prolongada, como
consecuencia del shock séptico, puede provocar leucomalacia periventricular.
(19,30,35) Aunque existen pocos datos, en neonatos se pueden administrar bolos
de líquido (solución salina) de 10 ml/kg (hasta 40 ml/kg en la primera hora).
(3,30) La infusión de líquidos siempre debe ajustarse a los marcadores clínicos
del gasto cardíaco (es decir, hepatomegalia o aumento del trabajo respiratorio).
Deben suspenderse si se desarrollan signos de sobrecarga de líquidos. (27,30)
En
recién nacidos prematuros hipotensos, algunos investigadores recomiendan que se
administre un bolo único de solución salina (10 a 20 ml/kg durante 30 a 60
minutos) y, si es necesaria una intervención adicional, comenzar con
medicamentos vasoactivos. (36)
El llenado de volumen está indicado antes de la intubación en casos de shock
séptico severo, ya que la sedación analgésica podría precipitar una
inestabilidad hemodinámica severa. (30) Si no hay respuesta al llenado de
volumen, se deben infundir inotrópicos dentro de 1 hora de inicio (dopamina, dobutamina, epinefrina).
Guías recientes recomiendan el uso preferencial
de epinefrina o norepinefrina (en comparación con dopamina) como catecolaminas de primera línea en niños con shock séptico, ya que
el efecto inotrópico y vasopresor es mayor y útil en el tratamiento del shock séptico
refractario a líquidos. (27)
Existe un gran vacío de estudios sobre el
uso de aminas en el período neonatal. La norepinefrina es actualmente el fármaco
inotrópico de primera línea en el shock séptico infantil. (37,38,39) Se
realizó un estudio controlado aleatorizado doble ciego (40) en 40 neonatos (de
los cuales 18 tenían ≤ 30 y 22 tenían ≥ 31 semanas de gestación respectivamente)
con shock séptico refractario a líquidos. La epinefrina fue más eficaz que la
dopamina para revertir el shock y la inestabilidad hemodinámica en recién
nacidos prematuros ≤ 30 semanas de gestación, mientras que la epinefrina y la norepinefrina tuvieron una seguridad y eficacia comparables (50
% versus 30 %; RR 1.67 (IC del 95 % 0.75- 3.71) en neonatos con mayor edad gestacional (≥ 31 semanas).(40)
Un estudio observacional retrospectivo durante un período de 10 años incluyó a
279 bebés prematuros (≤ 32 semanas de gestación) con LOS, de los cuales 25
progresaron a shock séptico. Las indicaciones para la administración de bolos de
líquidos y vasopresores fueron presión arterial < 20% y 41% por debajo de la
encontrada antes del inicio de los síntomas de la enfermedad, respectivamente.
Los autores no encontraron cambios hemodinámicos significativos cuando se
administró el primer bolo de líquido, pero el inicio de los vasopresores aumentó
significativamente la presión arterial y la frecuencia cardíaca (p < 0.01). Este estudio muestra que los vasopresores,
no los bolos de líquidos, aumentaron significativamente la presión arterial y la
frecuencia cardíaca. (41)
Las infecciones potencialmente mortales requieren el
uso empírico inmediato y agresivo de antibióticos bactericidas. El retraso en el
inicio de antibióticos para tratar el shock séptico se ha asociado con un mal
resultado y un mayor riesgo de mortalidad. En adultos con shock séptico
hipotensivo , se encontró que la sobrevida disminuye en un 7.6% por cada hora
de retraso en la administración de antibióticos. (42) A pesar de la muy baja
calidad de la evidencia, las guías recientes para el manejo del shock séptico y
la disfunción orgánica asociada a la sepsis en niños sugieren administrar
antimicrobianos lo antes posible, pero dentro de la primera hora del
reconocimiento. (27) Dos estudios observacionales retrospectivos investigaron la
asociación entre la administración temprana de antibióticos y la disminución de
la mortalidad por sepsis en la edad pediátrica. (43,44)
El primer estudio (43) se realizó en 130 niños sépticos (mediana de edad de 7.7
años), de los cuales 103 presentaban shock séptico. La mediana de tiempo desde
el reconocimiento de la sepsis hasta la administración de antimicrobiano inicial
fue 140 minutos. El riesgo de mortalidad aumentó cuando se administraron antimicrobianos ≥ 3 horas después del reconocimiento de la sepsis (OR no
ajustado 3.92, IC del 95 % 1.3-12.1). Se llevó a cabo un estudio más amplio (de
2014 a 2016) en 54 hospitales de EE. UU. Los niños con sepsis o shock séptico
(promedio de edad 7.2 años; ingresados en Servicio de Urgencia o ya hospitalizados fueron 1.179.
Entre ellos, 811 (68.8%) fueron
diagnosticados como shock y 139 (11.8%) fallecieron. Se encontró una menor
probabilidad ajustada a riesgo de mortalidad hospitalaria (OR 0.59, IC del 95
%, 0.38-0.93, P = 0.02) cuando se lograron los tres elementos del paquete (bundle) de
sepsis de 1 hora (hemocultivo tomado antes de la administración de
antibióticos). , antibióticos de amplio espectro administrados y finalización de
al menos 20 ml/kg de bolo de líquido cristaloide). (44) Desafortunadamente, los
datos sobre asociaciones entre outcome neonatal y administración
temprana de antibióticos son muy escasos. Schmatz y colaboradores investigaron
el momento de inicio de los antibióticos y la mortalidad a los 7, 14 y 30 días
en 113 recién nacidos con sepsis comprobada por cultivo. Aunque la población de
pacientes era muy heterogénea y no se pudo definir un límite de tiempo claro,
los investigadores demostraron una asociación entre el retraso en la
administración de antibióticos y un mayor riesgo tanto de mortalidad como de
disfunción cardiovascular prolongada. (45)
Los antibióticos de amplio espectro contra los patógenos más probables de EOS y
LOS deben administrarse de inmediato en el shock séptico. Una combinación de
ampicilina y gentamicina sigue siendo una terapia empírica apropiada para EOS.
Una penicilina semisintética (oxacilina o nafcilina), en combinación con un
aminoglucósido, es una terapia empírica apropiada para LOS. Se deben agregar
cefalosporinas de tercera generación cuando se sospecha meningitis. La punción
lumbar sigue siendo una herramienta esencial para el diagnóstico de sepsis o
meningitis, orientando las terapias antibióticas adecuadas. Sin embargo, a
menudo es necesario diferir la punción lumbar si el neonato presenta
inestabilidad hemodinámica. (46)
Por tanto, más aún en estos casos, las
terapias antibióticas empíricas deben tener un espectro especialmente amplio. De
hecho, deben ser rápidamente eficaces en los casos más graves. Se debe usar
piperacilinazobactam, carbapenem o cefepima para la cobertura de Gram-negativos,
en neonatos que se sabe que están colonizados con organismos Gram-negativos
resistentes. La terapia empírica debe reevaluarse dentro de las 48 horas; los
antibióticos con el espectro más estrecho (desescalada) y que se distribuyan al
sitio del cuerpo infectado deben administrarse de acuerdo con el patógeno
recuperado de los cultivos. Los antibióticos deben suspenderse si el recién
nacido ha mejorado y los cultivos sistémicos son estériles. Los programas de
administración de antimicrobianos (antimicrobial
stewardship programs) pueden guiar la elección óptima de
medicamentos, dosis y duración de las terapias. (47,48)
En conclusión, el reconocimiento y el
tratamiento rápidos de la sepsis y el shock séptico mejoran el pronóstico, y los
enfoques iniciales son clave para mejorar el resultado. Recientemente, se han
definido enfoques para el tratamiento del choque séptico en adultos, pero aún
faltan evidencias sólidas con respecto a los recién nacidos. Existe la necesidad
de realizar estudios bien diseñados para esclarecer estos aspectos en el período
neonatal.
Referencias
Aneja RK, Varughese-Aneja R, Vetterly CG, et al. Antibiotic therapy in neonatal and pediatric septic shock. Curr Infect Dis Rep 2011;13:433-41.
Agyeman PKA, Schlapbach LJ, Giannoni E, et al. Pediatric Sepsis Study. Epidemiology of blood culture-proven bacterial sepsis in children in Switzerland: a population-based cohort study. Lancet Child Adolesc Health 2017;1:124-133.
Wynn JL, Wong HR. Pathophysiology and treatment of septic shock in neonates. Clin Perinatol 2010;37:439-79.
Wynn JL. Defining neonatal sepsis. Curr Opin Pediatr 2016;28:135-40.
Shane AL, Sánchez PJ, Stoll BJ. Neonatal sepsis. Lancet 201714;390:1770-1780.
Berardi A, Baroni L, Bacchi Reggiani ML, et al. GBS Prevention Working Group Emilia-Romagna. The burden of early-onset sepsis in Emilia-Romagna (Italy): a 4-year, population-based study. J Matern Fetal Neonatal Med 2016;29:3126-31.
Berardi A, Sforza F, Baroni L, et al. Epidemiology and complications of late-onset sepsis: an Italian area-based study. PLoS One 2019;14:e0225407.
Berardi A,Ficara M, Pietrella E, et al. Stewardship antimicrobica nel neonato e nel piccolo lattante. Perché e come praticarla, Medico e Bambino 2017;36:493-501,
Wilson CB, Nizet V, Maldonado YA et al. Infecious diseases of the fetus and newborn infant, Elsevier, 2016.
M. Barbara J. Stoll, M. P. Karen M. Puopolo, M. Nellie I. Hansen, et al. Early-Onset Neonatal Sepsis 2015 to 2017, the Rise of Escherichia coli, and the Need for Novel Prevention Strategies. JAMA Pediatrics 2020;E1-E12.
Schrag SJ, Farley MM, Petit S, Reingold A, Weston EJ, et al. Epidemiology of Invasive Early-Onset Neonatal Sepsis, 2005 to 2014. Pediatrics 2016;138:e20162013.
Berardi A, Di Fazzio G, Gavioli S, et al. GBS Prevention Working Group, Emilia-Romagna. Universal antenatal screening for group B streptococcus in Emilia-Romagna. J Med Screen 2011;18:60-4.
Van Dyke MK, Phares CR, Schrag SJ et al. Evaluation of universal antenatal screening for group B streptococcus. N Engl J Med 2009;360:2626-36.
Vergnano S, Menson E, Kennea et al. Neonatal infections in England: the NeonIN surveillance network. Arch Dis Child Fetal Neonatal Ed 2011;96:F9-F14.
Cailes B, Kortsalioudaki C, Buttery J et al. Epidemiology of UK neonatal infections: the neonIN infection surveillance network. Arch Dis Child Fetal Neonatal Ed. 2018;103:F547-F553.
Pammi M, Weisman LE et al. Late-onset sepsis in preterm infants: update on strategies for therapy and prevention. Expert Rev Anti Infect Ther 2015;13:487-504.
Ficara M, Pietrella E, Spada C, et al. Changes of intestinal microbiota in early life. J Matern Fetal Neonatal Med 2020;33:1036-1043.
Richard Polin, Steven Abman. Fetal and Neonatal Physiology, Elsevier, Fifth Edition, vol. 1, 2016;1536-1551.
Goldstein B, Giroir B, Randolph A et al. International Consensus Conference on Pediatric Sepsis. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med 2005;6:2-8.
McGovern M, Giannoni E, Kuester H, et al. Infection, Inflammation, Immunology and Immunisation (I4) section of the ESPR. Challenges in developing a consensus definition of neonatal sepsis. Pediatr Res 2020;88:14-26.
Schlapbach LJ, MacLaren G, Festa M, et al. Australian & New Zealand Intensive Care Society (ANZICS) Centre for Outcomes & Resource Evaluation (CORE) and Australian & New Zealand Intensive Care Society (ANZICS) Paediatric Study Group. Prediction of pediatric sepsis mortality within 1 h of intensive care admission. Intensive Care Med 2017;43:1085-1096.
Schlapbach LJ, Kissoon N. Defining Pediatric Sepsis. JAMA Pediatr 2018;172:312-314.
Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;315:801-10.
Schlapbach LJ, Straney L, Bellomo R, et al. Prognostic accuracy of age-adapted SOFA, SIRS, PELOD-2, and qSOFA for in-hospital mortality among children with suspected infection admitted to the intensive care unit. Intensive Care Med 2018;44:179-188.
Angus DC, van der Poll T. Severe sepsis and septic shock. N Engl J Med 2013;369:2063.
Wynn JL, Polin RA. Progress in the management of neonatal sepsis: the importance of a consensus definition. Pediatr Res 2018;83:13-15.
Weiss SL, Peters MJ, Alhazzani W, et al. Surviving Sepsis Campaign International Guidelines for the Management of Septic Shock and Sepsis-Associated Organ Dysfunction in Children. Pediatr Crit Care Med 2020;21:e52-e106.
Luthander J, Bennet R, Giske CG, et al. Trends of Pediatric
Bloodstream Infections in Stockholm, Sweden:
A 20-year Retrospective Study. Pediatr Infect Dis J
2020;39(12):1069-1074.
Carcillo JA. A synopsis of 2007 ACCM clinical practice parameters for hemodynamic support of term newborn and infant septic shock. Early Hum Dev 2014;S45-7.
Davis AL, Carcillo JA, Aneja RK, et al. American College of Critical Care Medicine Clinical Practice Parameters for Hemodynamic Support of Pediatric and Neonatal Septic Shock. Crit Care Med 2017;45:1061-1093.
Weiss SL, Keele L, Balamuth F, et al. Crystalloid
Fluid Choice and Clinical Outcomes in Pediatric Sepsis:
A Matched Retrospective Cohort Study. J Pediatr
2017;182:304-310.e10.
Emrath ET, Fortenberry JD, Travers C, et al. Resuscitation With Balanced Fluids Is Associated With Improved Survival in Pediatric Severe Sepsis. Crit Care Med 2017;45:1177-1183.
Arikan AA, Zappitelli M, Goldstein SL, et al. Fluid overload
is associated with impaired oxygenation and morbidity
in critically ill children. Pediatr Crit Care Med
2012;13:253-8.
Sankar J, Ismail J, Sankar MJ, et al. Fluid Bolus Over 15-20 Versus 5-10 Minutes Each in the First Hour of Resuscitation in Children With Septic Shock: A Randomized Controlled Trial. Pediatr Crit Care Med 2017;18:e435-e445.
Russell MJ, Kanthimathinathan HK. Is There an Optimum Duration of Fluid Bolus in Pediatric Septic Shock? A Critical Appraisal of “Fluid Bolus Over 15-20 Versus 5-10 Minutes Each in the First Hour of Resuscitation in Children With Septic Shock: A Randomized Controlled Trial” by Sankar et al (Pediatr Crit Care Med 2017; 18:e435-e445). Pediatr Crit Care Med 2018;19:369-371.
Seri I, Evans J. Controversies in the diagnosis and management of hypotension in the newborn infant. Curr Opin Pediatr 2001;13:116-23.