Reanmación de RN con displasia broncopulmonar
Diciembre 2024
Principios de reanimación para niños con displasia broncopulmonar severa
Summer Elshenawy Seminars in Perinatology Diciembre 2024
Abreviaturas :
ASD, atrial septa defect; ECLS, Extracorporeal life support; LV, Left ventricle; NICU, Neonatal intensive care unit; NRP, Neonatal Resuscitation Programs;
PALS, Pediatric Advances Life Support; PEEP, Positive end expiratory pressure;
PH, Pulmonary hypertension; PVD, Pulmonary vascular disease; PVR,
Pulmonary vascular resistance; PVS, Pulmonary vein stenosis; sBPD, Severe
bronchopulmonary dysplasia.
Introducción
Los lactantes con displasia broncopulmonar grave (DBP), en particular los que
dependen de un ventilador, tienen un alto riesgo de deterioro agudo y posterior
paro cardiorrespiratorio. Aunque se desconocen las tasas de insuficiencia aguda
en lactantes con DBP, los estudios observacionales indican que un tercio de los
lactantes que sufren un paro cardiorrespiratorio en las unidades de cuidados
intensivos neonatales (UCIN) tienen DBP con cerca del 80 % de los pacientes en
ventilación mecánica en el momento del paro.1 La reanimación de
lactantes con DBP puede realizarse en la UCIN, en unidad de cuidados intensivos
pediátricos, en sala pediátrica general o unidades de rehabilitación.2
Por ello, la compleja fisiología cardiopulmonar y las razones del deterioro en
lactantes con DBP severa requieren consideraciones especiales para la
reanimación en todos los entornos. Sin embargo, las directrices de reanimación
neonatal y pediátrica no se han adaptado a esta población única. Hay aspectos
distintos de la atención preventiva y posterior a la reanimación que también
deben considerarse en el tratamiento de lactantes con DBP severa . Por ejemplo,
el cuidado de reanimación del lactante con DBP severa no solo depende de la
identificación de fenotipos superpuestos de enfermedades respiratorias,
cardiovasculares e infecciosas, sino también de la fase de cuidado de DBP severa
en la que se produce el deterioro.2,3
Para informar sobre los principios de reanimación y prevención del paro cardíaco en lactantes con DBP severa, en esta revisión resumimos los fenotipos de DBP severa, las fases de cuidado y los desencadenantes comunes de las exacerbaciones agudas. Presentamos un marco de reanimación basado en la fisiología para esta población que se centra en estrategias específicas para cada fenotipo de DBP severa teniendo en cuenta la patología de las vías respiratorias, los principios de ventilación, los agentes cardioterapéuticos y el reconocimiento apropiado para el soporte vital extracorpóreo (ECLS). Por último, analizamos la planificación preventiva y el cuidado posterior a la reanimación.
Descifrando el deterioro agudo en
DBP severa
La descompensación aguda que requiere reanimación
se conoce comúnmente como una “crisis de DBP”. La
estabilidad en los niños con DBP severa es un equilibrio entre las
necesidades de cuidado fenotípicas y de la fase en la que se encuentra el bebé
y el nivel de apoyo actual. Los factores desencadenantes del deterioro pueden
alterar el equilibrio y provocar una crisis de DBP severa. La
fisiopatología subyacente del deterioro agudo en los niños con DBP severa se entiende mejor con respecto a
su fase de cuidado, el fenotipo de
DBP severa y los factores desencadenantes comunes del
deterioro.
Fases de cuidado de
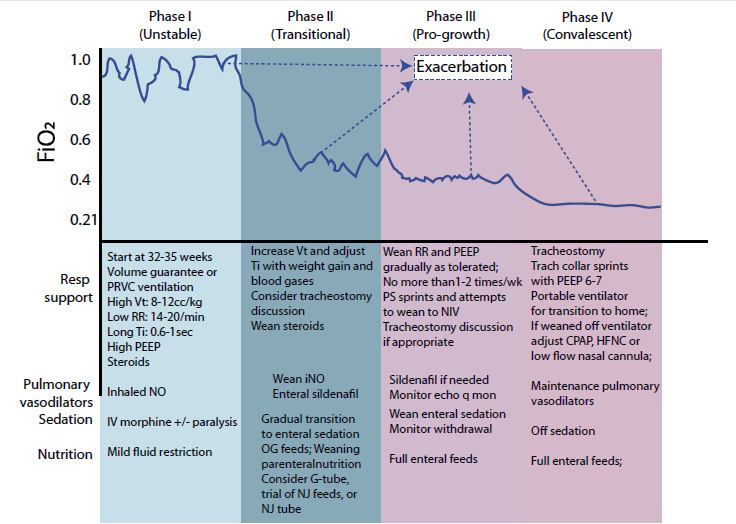
DBP severa
Los bebés con DBP severa evolucionan a
lo largo de un continuo a través de 4 fases de cuidado : 1) Fase I:
inestable; 2) Fase II: de transición; 3) Fase III: crecimiento progresivo; y 4)
Fase IV: convaleciente (Figura 1).4
Comprender la fase actual de atención de un bebé con DBP
severa puede ayudar a los equipos a predecir el riesgo de paro cardíaco y
estimar la trayectoria de recuperación esperada del bebé.2,3 Los
bebés en la Fase 1 tienen el mayor riesgo de paro cardíaco, aunque el deterioro
agudo puede ocurrir en cualquier fase. Los bebés en las Fases 1 y 2 pueden tener
más dificultades y tardar más en recuperarse a su estado inicial previo al
deterioro.

Figura 1. Características de la fase de cuidado de la displasia broncopulmonar
grave
PRVC, pressure regulated volume control ventilation; Vt, tidal volume;
RR, respiratory rate; Ti, inspiratory time; PEEP, positive end expiratory
pressure; NO; nitric
oxide, iNO – inhaled nitric oxide IV, intravenous; NJ, naso-jejunal; G,
gastric; echo, echocardiogram; CPAP, continuous positive airway pressure, HFNC,
high flow
nasal cannula; PS – pressure support; NIV – noninvasive ventilation;.
La fase I se caracteriza por inestabilidad fisiológica que se manifiesta como
combinaciones variables de a) labilidad respiratoria con aumento del trabajo
respiratorio, episodios de desaturación que requieren altas concentraciones de
oxígeno e incapacidad para sincronizarse con el respirador; b) labilidad
hemodinámica con bradicardia y evidencia de hipertensión pulmonar (HP); c)
déficits nutricionales con anasarca y sobrecarga de líquidos, y d) compromiso
neurológico con altos requerimientos de sedantes, intolerancia a las actividades
diarias, fatiga y reacciones conductuales alteradas con una actividad mínima. El
objetivo de la fase I es mejorar la estabilidad fisiológica con un manejo activo
agudo y día a día.
La fase II ocurre cuando se ha logrado la estabilidad cardiopulmonar,
como lo evidencian los requerimientos estables de oxígeno y ventilación y la
tolerancia a la actividad mejorada. El objetivo de la fase II es reducir aún más
la labilidad fisiológica mejorando las reservas pulmonares, optimizando la
nutrición, mejorando la tolerancia a la actividad y retirando las medidas que se
usaron en la fase inestable (por ej., esteroides, relajación muscular, sedación).
Se puede considerar la colocación de tubos de traqueotomía y/o gastrostomía si
existe una necesidad continua de soporte de presión positiva para insuficiencia
respiratoria crónica, anomalías en las vías respiratorias superiores o
enfermedad vascular pulmonar (EVP) grave.5
La fase III se caracteriza por una oxigenación estable con eventual weaning del soporte respiratorio, mayor tolerancia a la actividad diaria creciente y un peso y crecimiento lineal adecuados.
La fase IV es aquella en la que los bebés tienen una reserva respiratoria suficiente para permitir el weaning de la medicación respiratoria, la transición a respiradores en el hogar, interacciones sostenidas con su entorno y la mejora del desarrollo neurológico. Una exacerbación aguda puede hacer que un bebé retroceda de su estado inicial dentro de una fase, pero no necesariamente a una fase anterior.
Fenotipos de DBP
El segundo factor determinante en la fisiopatología del paro
en DBP severa es el
fenotipo subyacente del bebé. La compleja fisiopatología de la DBP da lugar a
diferentes fenotipos que afectan al parénquima pulmonar, las vías respiratorias,
la vasculatura pulmonar y la función cardíaca de formas distintivas.2,3 (Figura
2). Se han descrito siete fenotipos clave de la DBP severa en la literatura, y los
bebés suelen caracterizarse por más de uno. Estos incluyen: alveolar, vías
respiratorias pequeñas, vías respiratorias grandes, vascular pulmonar (y su
forma más grave, hipertensión pulmonar), anasarca, infeccioso e intersticial.
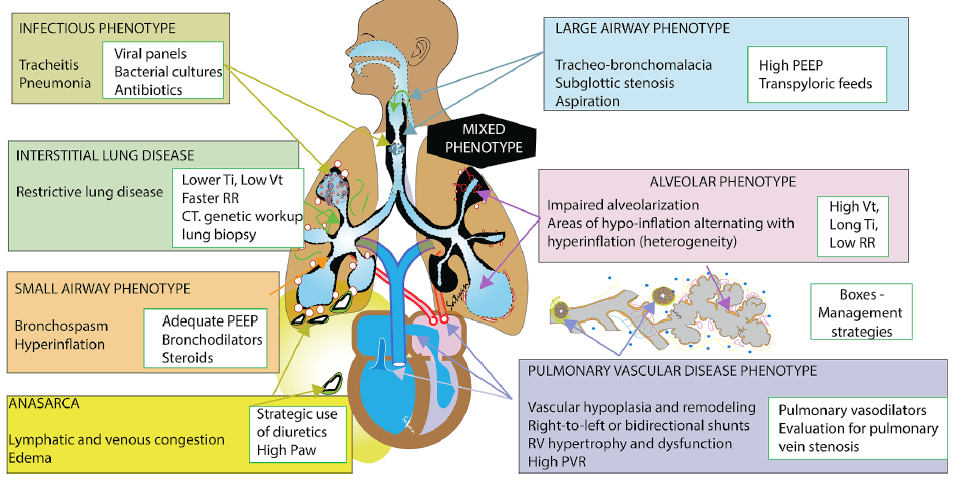
Figura 2. Fenotipos de displasia broncopulmonar y consideraciones de manejo. Los cuadros blancos con contorno verde brindan estrategias de manejo dentro de cada fenotipo. Un fenotipo mixto puede incluir diversas proporciones de los diferentes fenotipos enumerados anteriormente. Copyright Satyan Lakshminrusimha, with permission. Ti, inspiratory time; CT, computed tomography; PEEP, positive end expiratory pressure; RR, respiratory rate; Paw, mean airway pressure; Vt, tidal volume; PVR – pulmonary vascular resistance.
El objetivo del manejo de la displasia broncopulmonar
severa es
desarrollar estrategias basadas en el fenotipo de displasia broncopulmonar del
lactante que promuevan una progresión continua a través de cada fase del cuidado, al mismo tiempo que se utilizan las características fenotípicas
específicas para guiar a) la prevención del paro cardíaco, b) el manejo de las
exacerbaciones agudas y c) la reanimación. Curiosamente, cada fenotipo puede
contribuir de manera diferente a la misma presentación clínica común (Tabla 1).
Por ejemplo, tres lactantes diferentes con displasia broncopulmonar severa pueden
presentar insuficiencia respiratoria hipoxémica, pero cada lactante puede tener
una etiología de crisis de displasia broncopulmonar subyacente diferente según
su fenotipo (p. ej., alveolar, vascular pulmonar o de las vías respiratorias
grandes) y responder de manera diferente a las estrategias de ventilación,
medicamentos y otras intervenciones.
Tabla 1.- Fenotipos de
displasia broncopulmonar grave y consideraciones para el manejo en el deterioro
agudo. (Al final de este artículo)
Factores desencadenantes comunes del deterioro agudo en
lactantes con DBP severa
El deterioro en lactantes con Displasia
broncopulmonar severa es
desencadenado comúnmente por enfermedad pulmonar parenquimatosa aguda,
obstrucción de las vías respiratorias, aumentos repentinos de la resistencia
vascular pulmonar (RVP), aspiración o infección. Diferentes procedimientos
quirúrgicos o mínimamente invasivos (p. ej., colocación de traqueotomía, sonda
de gastrostomía, cirugía láser para retinopatía del prematuro) también pueden
ser desestabilizadores para estos pacientes de alto riesgo (Figura
3).
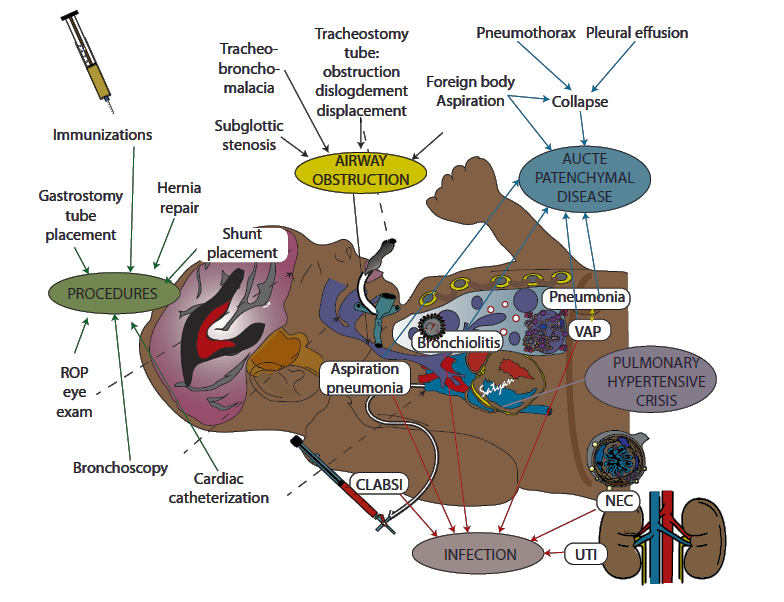
Fig. 3. Factores desencadenantes comunes del deterioro agudo en lactantes con displasia broncopulmonar grave. La obstrucción de las vías respiratorias, la enfermedad pulmonar parenquimatosa aguda, los procedimientos, las infecciones y las crisis hipertensivas pulmonares causadas por diversos factores que se muestran en la figura pueden provocar un deterioro agudo de la displasia broncopulmonar.
ROP,
retinopathy of prematurity; NEC, necrotizing enterocolitis: UTI, urinary
tract infection; CLABSI, central line associated bloodstream infection; VAP,
ventilator
associated pneumonia; Copyright Satyan Lakshminrusimha, used with
permission.
Enfermedad pulmonar parenquimatosa aguda
La enfermedad pulmonar parenquimatosa aguda puede ser
consecuencia de una ventilación subóptima, aspiración o infecciones tales como
la neumonía asociada al ventilador o la bronquiolitis viral. Si bien los
lactantes con fenotipo alveolar sBPD (DBP severa) son los que tienen mayor
riesgo de padecer esta etiología, se trata de un desencadenante común para todos
los lactantes con sBPD. En la enfermedad parenquimatosa aguda, la pérdida de
volumen (por atelectasia o por consolidaciones) puede estar distribuida de
manera desigual, lo que precipita un paro cardiopulmonar hipóxico con un aumento
de la heterogeneidad pulmonar y un empeoramiento del desajuste
ventilación-perfusión.
Obstrucción de las vías respiratorias
Los lactantes con fenotipo de vías respiratorias grandes, los lactantes con
lesiones adquiridas de vías aéreas y los lactantes con traqueostomía
son los que tienen mayor riesgo de deterioro por obstrucción de las vías
aéreas. En los lactantes con traqueobroncomalacia, una presión positiva
al final de la espiración (PEEP) inadecuada debido al destete, la agitación o
incluso una maniobra de Valsalva puede provocar una obstrucción dinámica de las
vías respiratorias y precipitar un aumento del trabajo respiratorio,
atrapamiento de aire y falla de la ventilación.6 La obstrucción de las vías
aéreas también puede ser consecuencia de emergencias de traqueostomía
(desplazamiento, obstrucción, desplazamiento) y de estenosis subglótica.7
Crisis hipertensiva pulmonar
Los lactantes con fenotipo PVD (Pulmonary vascular disease) tienen mayor riesgo de sufrir una crisis
hipertensiva pulmonar y paro. Una crisis hipertensiva pulmonar es un
aumento agudo y repentino de la presión arterial pulmonar que produce una
sobrecarga del corazón derecho, una disminución del flujo sanguíneo pulmonar
anterior y una presentación clínica de hipoxia aguda. La posterior disminución
del llenado del corazón izquierdo conduce a una disminución del gasto cardíaco
sistémico. Una crisis hipertensiva pulmonar también aumenta la demanda de
oxígeno del miocardio a medida que disminuyen la presión de perfusión coronaria
y el flujo sanguíneo coronario. Esta constelación de eventos conduce
inicialmente a la aparición aguda de insuficiencia cardíaca derecha. La
combinación de hipoxia, disminución del gasto cardíaco y acidosis metabólica
resultante puede provocar hipotensión sistémica, isquemia miocárdica, paro
cardíaco e incluso la muerte.8
La HP crónica asociada con la DBPs se debe con mayor frecuencia a la
remodelación de la vasculatura pulmonar y al aumento de la RVP (resistencia
vascular pulmonar) . El fenotipo de
HP crónica también puede deberse a un cortocircuito sistémico-pulmonar
persistente (p. ej., conducto arterioso persistente, defectos del tabique
auricular o ventricular) con un alto volumen de sangre en los pulmones que
conduce a una distensibilidad limitada, remodelación vascular, edema
intersticial [impulsado por el flujo] y/o alteraciones en el gradiente de
presión transpulmonar que resulta de un fenotipo del corazón izquierdo (p. ej.,
hipertensión sistémica, disfunción diastólica del ventrículo izquierdo o
estenosis de la vena pulmonar, PVS). El subgrupo de lactantes con DBPs que desarrollan estenosis de la vena pulmonar (PVS) también tienen un mayor
riesgo de sufrir una crisis hipertensiva pulmonar. Los estudios observacionales
han demostrado una alta tasa de mortalidad entre los lactantes con DBPs y
PVS , siendo la crisis hipertensiva pulmonar la causa de muerte con
frecuencia.9
Episodios de malacia
Los episodios de malacia de las vías respiratorias
son episodios cianóticos que se presentan con mayor frecuencia con el fenotipo
de vía aérea grande (traqueobroncomalacia) en los bebés con DBPs.
Los episodios de malacia se presentan con dificultad respiratoria y síntomas que
incluyen estridor espiratorio, asistencia respiratoria disincrónica y necesidad
de asistencia con PEEP alta. El grado de colapso de las vías respiratorias
depende de la presión aplicada a la pared de las vías respiratorias y de la
rigidez de las mismas. Aumentar la PEEP o proporcionar estrategias de sedación
mejoradas puede ayudar a mitigar un episodio de malacia.
Aspiración
La aspiración es una consideración especial para los bebés con DBPs y puede ser resultado de la aspiración de secreciones orales y/o contenido de reflujo gástrico. La fisiopatología de la aspiración en esta población incluye deglución inmadura o patológica, disminución de la protección de las vías aéreas y espectro de reflujo gastroesofágico.10 Los eventos de aspiración repetidos pueden causar inflamación crónica y empeoramiento de la enfermedad pulmonar parenquimatosa o HP.11
Además, un evento de aspiración significativo podría causar obstrucción de vías aéreas, neumonía por aspiración o traqueítis que causan deterioro agudo de los bebés con DBPs. Los factores de riesgo de aspiración incluyen: edad posnatal más temprana, lesión cerebral comórbida, anomalías de vías aéreas superiores (p. ej. paresia de las cuerdas vocales, laringomalacia/traqueomalacia),12 alimentación gástrica u oral, antecedentes de reflujo gastroesofágico grave, trabajo respiratorio severo, diferencias genéticas asociadas con hipotonía, tubos endotraqueales sin cuff o tubos de traqueotomía.13 La aspiración también se ha relacionado con una respuesta deficiente al tratamiento en niños con PVS.14
Infecciones
Algunos lactantes con DBPs tienen un fenotipo infeccioso que produce traqueítis frecuente (Tabla 1). Los lactantes con DBPs corren el riesgo de contraer infecciones pulmonares y sistémicas debido a un componente de desregulación inmunitaria. Los dispositivos médicos invasivos y permanentes, tales como los tubos endotraqueales, la traqueotomía y las vías centrales, aumentan aún más el riesgo de contraer infecciones adquiridas asociadas con atención en salud, tales como neumonía asociada a la ventilación mecánica e infecciones del torrente sanguíneo asociadas a vías centrales.15 Los lactantes con DBPs también corren el riesgo de aspiración, lo que causa a neumonía por aspiración. Si bien las infecciones pulmonares dan lugar a una enfermedad pulmonar parenquimatosa aguda que causa deterioro respiratorio agudo, las infecciones sistémicas pueden precipitar una respuesta inflamatoria que puede causar síndrome de dificultad respiratoria aguda, comprometiendo aún más la oxigenación y la ventilación en lactantes con una función pulmonar ya frágil.16 Al igual que en la población general, las infecciones sistémicas también pueden provocar shock séptico, lo que lleva a un paro cardiopulmonar en el lactante con DBPs médicamente frágil.
Procedimientos y otros eventos desestabilizadores
Los bebés con DBPs , en particular aquellos en las
primeras fases de cuidado, menos estables, corren el riesgo de desestabilizarse
a partir de eventos que serían bien tolerados por otros bebés. Esto incluye
procedimientos de rutina, tales como exámenes de retina y vacunación, y procedimientos invasivos,
tales como reparaciones de hernias, colocación de vías centrales, broncoscopias, creación de traqueostomías y cateterismo cardíaco. Estos eventos
pueden causar una mayor demanda metabólica, cambios en la ventilación
crónica estable, perturbación directa de las vías aéreas, cambios en el
tono vascular pulmonar y sistémico y otras alteraciones en un bebé con un
equilibrio homeostático frágil. Se necesita una consideración y planificación
cuidadosas antes de que se produzcan dichos eventos esperados, en particular
cuando se requiere sedación o anestesia.
Principios de reanimación de un lactante con DBP
severa en deterioro
La identificación de la fase actual de cuidado, el
fenotipo de DBPs y los desencadenantes previstos permiten elaborar
planes de atención individualizados que se pueden implementar para prevenir una
crisis de DBP, facilitar el reconocimiento temprano de
desestabilizaciones e informar sobre una reanimación eficaz en caso de paro
cardíaco. Como tal, los principios fundamentales del plan de reanimación se
basan en la atención multidisciplinaria, los principios básicos de ABCDEs ,
la farmacoterapia, las intervenciones de soporte vital y los cuidados
posteriores a la reanimación.
Enfoque multidisciplinario para la prevención de
crisis de sBPD
La colaboración multidisciplinaria
optimiza la prevención y reanimación de crisis de DBP mediante el desarrollo de
planes de atención integrales e individualizados basados en los principios de
la fase de cuidado de la DBP, el fenotipo y los desencadenantes de exacerbación
conocidos. Dichos planes de atención proporcionan un modelo mental compartido
para todo el equipo de atención, de modo que se optimice la atención diaria, se
puedan evitar los desencadenantes, se detecten de manera temprana los signos de
exacerbación de DBP y se tomen medidas de reanimación adaptadas al paciente
en caso de un evento de crosos DBP o un paro cardiopulmonar. El manejo de DBPs bajo
la guía de un equipo multidisciplinario mejora los resultados
(outcomes) hospitalarios.17,18 La estrategia general de tratamiento es optimizar las
influencias positivas que promueven el progreso hacia las fases de crecimiento y
convalecencia, al tiempo que se minimizan las exposiciones que pueden causar
descompensación aguda e interferir con el crecimiento pulmonar y el desarrollo
neurológico.
Los planes de
cuidado también pueden mejorar la conciencia situacional de los
equipos multidisciplinarios para estos bebés de alto riesgo. Se ha demostrado
que las listas de verificación (checklists) que identifican los signos de advertencia
tempranos del deterioro clínico mejoran los resultados de los pacientes.19 En
consecuencia, proporcionamos una herramienta de prevención del paro cardíaco por
DBPs en la Figura 4. Esta herramienta de "plan de enfermedad" destaca las
terapias de rescate individualizadas basadas en la fase actual de atención del
bebé, los fenotipos de DBPs y los desencadenantes, al tiempo que resume
sucintamente el estado actual del paciente. Proporcionar un resumen claro del
estado de un bebé identifica a los pacientes que pueden no estar en su estado
inicial y en riesgo de crisis y paro cardíaco por DBP. Identificar a estos
pacientes como "en observación" utilizando signos clínicos de deterioro ayudará
a prepararse para la reanimación. También ofrecemos estrategias de manejo para
el deterioro agudo, o un "plan de enfermedad", basado en el fenotipo (Tabla
1) para ayudar a guiar las medidas de reanimación
requeridas en caso de una crisis.

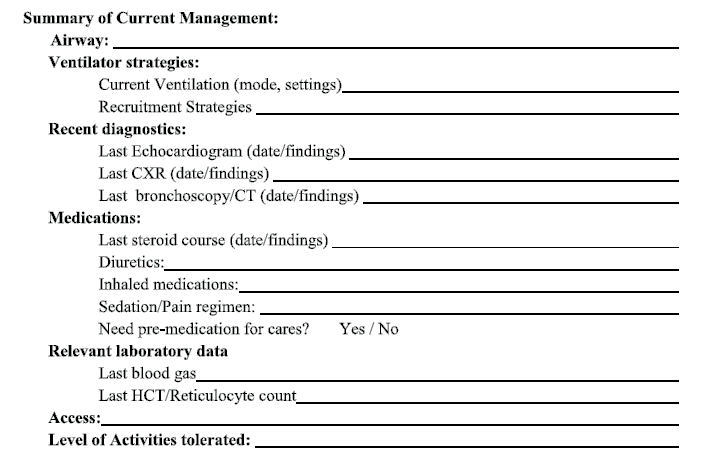
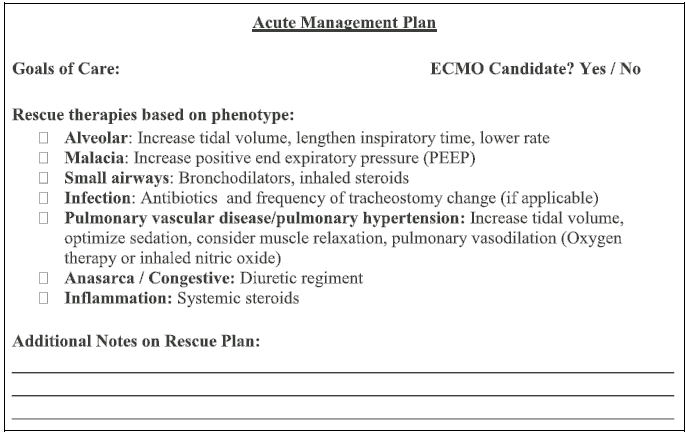

Figura 4. Severe Bronchopulmonary Dysplasia Arrest Prevention Tool.
Etiología del Paro
Aproximadamente el 50 % de todos los paros cardíacos pediátricos
intrahospitalarios se deben a causas respiratorias.20,21 En consecuencia, la
reanimación inicial del lactante con DBPs se debe centrar en establecer una
ventilación y oxigenación adecuadas. Los lactantes con DBP tienen reservas
pulmonares muy limitadas, lo que hace que sea muy difícil restablecer el
reclutamiento pulmonar. Si las intervenciones respiratorias fallan, puede
producirse un paro cardiopulmonar debido a una hipoxemia prolongada, acidosis o
disfunción miocárdica. Con menor frecuencia, los pacientes con DBPs pueden
experimentar un deterioro cardiopulmonar primario (p. ej., shock o una crisis
hipertensiva pulmonar) y una respuesta rápida para apoyar la circulación se
convierte en la prioridad.
ABCDEs de la reanimación de DBPs
El acrónimo “ABCDE” (A: Vía aérea, B: Respiración/ventilación, C: Circulación,
D: Medicamentos y otras intervenciones, y E: Consideración para ECLS ) puede
guiar los principios clave de la reanimación de sBPD como se muestra en la
Figura 5. Las intervenciones en cada categoría deben adaptarse a la fase de
cuidado, el fenotipo y los desencadenantes (gatillos) de cada bebé.
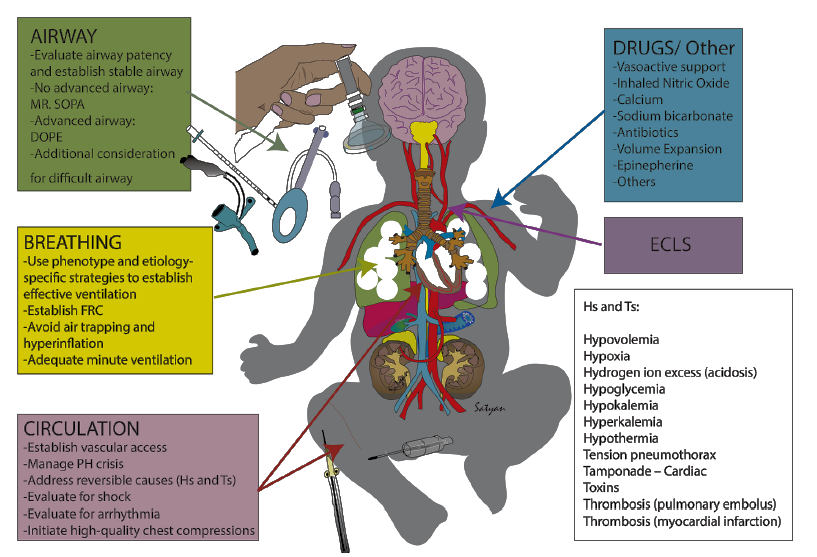
Fig. 5. Consideraciones para Reanimación de niños con
Displasia broncopulmonar severa
MR. SOPA, Mask adjustment, Reposition, Suction, Open the mouth, Pressure
increase, Airway; DOPE, dislodgement, obstruction, pneumothorax, equipment
failure;
FRC, functional residual capacity; PH, pulmonary hypertensive; ECLS,
extracorporeal life support.
A: Vía aérea: La reanimación de un lactante con DBP debe comenzar con la
evaluación y el establecimiento de la permeabilidad de la vía aérea. En el caso
de aquellos con vías aéreas avanzadas (tubos endotraqueales o de traqueotomía),
el equipo debe evaluar el desplazamiento, la obstrucción, el neumotórax y la
falla del equipo, según se detalla en la regla mnemotécnica DOPE.22 La
evaluación debe incluir la historia clínica del paciente, la visualización
directa de la vía aérea, la succión, la obtención de imágenes, la capnografía y
una revisión de los gráficos y las alarmas del respirador. Si es necesario,
puede ser necesario retirar el tubo endotraqueal o de traqueotomía para
facilitar la ventilación con mascarilla y el eventual reemplazo de la vía aérea.
En el caso de los pacientes sin una vía aérea avanzada, se debe optimizar la
ventilación con bolsa y mascarilla mediante medidas correctivas para establecer
una ventilación eficaz con el objetivo de estabilizar antes de intentar la
intubación para evitar un mayor deterioro. Si bien las medidas correctivas para
un paciente con DBP pueden diferir de las de un recién nacido en la sala de
partos, se aplican los mismos principios. Estos incluyen la colocación adecuada
y el sellado de la máscara para minimizar las fugas (incluida la ventilación con
máscara por dos personas), eliminar la obstrucción, aumentar las presiones
(según las necesidades previas y la distensibilidad pulmonar) y, en última
instancia, colocar una vía aérea avanzada si es necesario. Las consideraciones
específicas de las vías respiratorias para los bebés con DBPs incluyen
dificultades para ventilar con obstrucción anatómica (p. ej., estenosis
subglótica o traqueal) o desprendimiento de la vía aérea artificial (p. ej.,
traqueotomía).
En estas circunstancias, la documentación de una “contingencia crítica de vías aéreas" junto a la cama puede ser adecuada y debe incluir preocupaciones específicas de las vías aéreas (por ejemplo, intubación difícil), otras consideraciones (por ejemplo, necesidad de acceso intravenoso), recomendaciones para el manejo de las vías aéreas y detalles sobre la traqueotomía (Figura 6). La reintubación debe ser realizada por especialistas en procedimientos de intubación con experiencia, junto con métodos complementarios como la videolaringoscopia, para maximizar las posibilidades de éxito en la intubación al primer intento.23

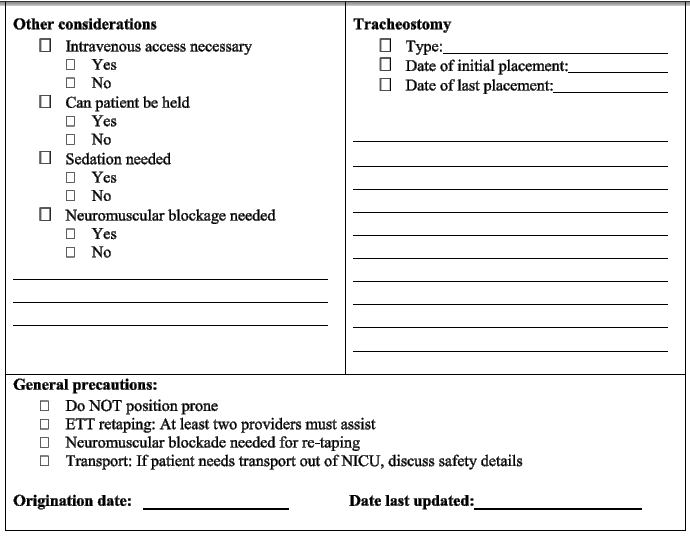
Fig. 6. Critical Airway Contingency for Severe Bronchopulmonary Dysplasia ETT, endotracheal tube; LMA, laryngeal mask airway,.
El uso de una máscara laríngea puede mejorar la ventilación efectiva si los intentos de intubación no tienen éxito o como medida temporal mientras se espera el apoyo avanzado para la vía aérea.24 Debe haber un tubo de traqueotomía de respaldo al lado de la cama con indicaciones para reemplazar un tubo de traqueotomía que funciona mal, ventilación con máscara a través del estoma de traqueotomía y participación inmediata del otorrinolaringólogo.7 La participación inmediata del otorrinolaringólogo es particularmente importante cuando el estoma aún no está maduro, ya que restablecer la vía aérea puede ser extremadamente difícil y propenso a complicaciones.23
B: Respiración/Ventilación: Los principios de una ventilación eficaz del pulmón
con DBPs se determinan logrando una ventilación minuto adecuada, optimizando el
reclutamiento alveolar con el establecimiento de la capacidad residual funcional
y evitando el atrapamiento de aire y la hiperinsuflación. Este equilibrio puede
ser un desafío con tejidos pulmonares heterogéneos con distensibilidad (compliance) y
resistencia variables, lo que lleva a constantes de tiempo y presiones de cierre
diferentes.25 Las exacerbaciones de DBPs complican aún más esta patología, lo
que requiere una ventilación personalizada para cada paciente en función del
fenotipo y la fase de cuidado (Tabla 1). Durante la reanimación, la ventilación
de un paciente con DBPs se basa en los principios generales de la ventilación de
DBPs . Para lograr una ventilación adecuada de pulmones heterogéneos, a menudo se
requieren presiones inspiratorias máximas altas, tiempo inspiratorio prolongado
y frecuencias respiratorias lentas para permitir constantes de tiempo
prolongadas y evitar la hiperinsuflación. 26 Esta estrategia es marcadamente
diferente de los métodos de ventilación utilizados para la mayoría de los
neonatos sin DBP establecida y se desvía de las frecuencias respiratorias
recomendadas en el Programa de reanimación neonatal (NRP, 40-60 lpm)24 y el
Soporte vital avanzado pediátrico (PALS, 20-30 lpm).27
Los lactantes con DBPs pueden requerir una PEEP más alta, especialmente aquellos con vías respiratorias grandes o enfermedad pulmonar intersticial. Una PEEP adecuada mantiene la capacidad residual funcional y aumentar la PEEP también puede prevenir el atrapamiento aéreo mediante la colocación de un stent que abra las vías respiratorias y permita la exhalación. Por otro lado, una PEEP excesiva puede causar hiperinsuflación que puede perjudicar el retorno venoso y empeorar el compromiso cardíaco. Si bien los requerimientos de PEEP pueden ser dinámicos, es fundamental comprender el fenotipo de un paciente y el estado de PEEP inicial con un enfoque en las radiografías de tórax más recientes, los estudios de titulación anteriores y la información de la broncoscopia o las imágenes dinámicas. La consideración de la farmacoterapia para ayudar en el reclutamiento pulmonar incluye sedación, limpieza de las vías respiratorias, broncodilatadores, esteroides e incluso bloqueo neuromuscular. Las maniobras de reclutamiento y rescate deben adaptarse a cada lactante en función del soporte respiratorio inicial, el fenotipo subyacente y el contexto de su exacerbación.
C: Circulación: Si bien es fundamental establecer la vía aérea y la respiración, ya que los bebés con sBPD suelen sufrir un paro cardíaco por causas pulmonares, las consideraciones circulatorias y cardiovasculares también son fundamentales en la reanimación. Los principios circulatorios clave se centran en la identificación y colocación del acceso intravascular, el inicio rápido de compresiones torácicas de alta calidad cuando sea necesario, la identificación de causas reversibles de paro cardíaco (p. ej., H´s y T¨s en PALS27) y el manejo de las crisis hipertensivas pulmonares. Las compresiones torácicas de alta calidad para mantener la perfusión y la circulación coronarias son esenciales para mejorar los resultados del paro cardiopulmonar. El equipo de reanimación debe lograr un equilibrio entre las acciones necesarias para restablecer una ventilación eficaz y el potencial de resultados adversos resultantes de los retrasos en el inicio de las compresiones torácicas. No se han establecido específicamente proporciones óptimas de compresiones torácicas a ventilación para la población con DBPs. Se pueden seguir las guías PALS o NRP, según la ubicación del paciente y las políticas específicas de la unidad.28 El uso de la herramienta de prevención de paro cardíaco por DBPs (Figura 3) puede ayudar a identificar estas causas reversibles antes en función de los factores de riesgo, lo que permite un tiempo más corto hasta el ROSC y mejores resultados.
La crisis hipertensiva pulmonar (HP) es una consideración circulatoria especial
en la reanimación de lactantes con DBPs. La acidosis y la hipoxemia pueden
aumentar la RVP, empeorar el desajuste ventilación-perfusión y deben tratarse de
forma agresiva. La corrección de todos los trastornos metabólicos y
electrolíticos, incluyendo acidosis, las anomalías de sodio y potasio y la hipocalcemia, puede mejorar la función cardíaca. El tratamiento incluye
analgesia adecuada, sedación y relajación muscular. La administración de agentes
inotrópicos puede mejorar la función del ventrículo derecho, mientras que los
vasopresores controlan la hipotensión sistémica y mejoran la perfusión
coronaria. 8 Los vasodilatadores pulmonares, tales como el óxido nítrico inhalado, los
análogos de la prostaciclina y los inhibidores de la fosfodiesterasa tipo V (p.
ej., sildenafil) pueden ser apropiados si la etiología del fenotipo vascular
pulmonar se debe a una RVP anormal, en lugar de un aumento del flujo sanguíneo
pulmonar o una enfermedad cardíaca izquierda. La incorporación de antecedentes
de ecocardiografía y cateterismo cardíaco en colaboración con colegas
cardiólogos ayudará a orientar la atención durante la descompensación aguda. En
los casos refractarios con bajo gasto cardíaco, se puede considerar la ECLS.
D: drugs, pharmacotherapy and other interventions
Además de la farmacoterapia incluida en el PNR y el PALS,
se pueden considerar medicamentos especiales para reanimación de lactantes con
DBPs durante la reanimación. Estos incluyen oxígeno, sedación, bloqueo
neuromuscular (parálisis) y esteroides sistémicos. Se requiere una titulación
cuidadosa de oxígeno para evitar exacerbar la lesión pulmonar y el daño
oxidativo. El enfoque en asegurar una oxigenación tisular adecuada es
particularmente crítico en los pacientes vulnerables con anemia o bajo gasto
cardíaco. El oxígeno actúa como un vasodilatador pulmonar y puede ayudar en la
descompensación debido a una crisis de HP. El objetivo de niveles de SpO2 de
90-95 % durante la reanimación y 94-99 % después de la recuperación de la
circulación espontánea debería ser adecuado para mantener este equilibrio.27
La sedación gradual y la relajación muscular pueden
reducir la RVP y también ayudar en las crisis hipertensivas pulmonares. La
sedación también puede ayudar a resolver los episodios de traqueobroncomalacia.
Se prefieren los sedantes de acción corta como el fentanilo o el midazolam.
Aunque los datos son limitados, la ketamina puede considerarse en pacientes
mayores con DBPs por su estabilidad hemodinámica y efectos broncodilatadores.29
Los relajantes musculares, incluyendo vecuronio y rocuronio, pueden ayudar
con la ventilación y la oxigenación después de que el paciente haya sido sedado
adecuadamente, al disminuir la demanda metabólica y relajar las contracciones
intercostales y diafragmáticas, mejorando la distensibilidad durante una crisis
aguda.
Los bebés con fenotipo de vía aérea pequeña pueden beneficiarse de los
broncodilatadores y los esteroides sistémicos, particularmente si hay evidencia
de obstrucción de la vía aérea pequeña, mayor resistencia o una fase espiratoria
prolongada. El uso de esteroides en dosis de estrés para bebés con riesgo de
insuficiencia suprarrenal debido a la exposición prolongada a esteroides es
común en la DBPs.
Soporte vital extacorpóreo (Extracorporeal life support o ECLS)
La selección de
pacientes para ECLS se guía principalmente por la reversibilidad de la afección.
Si bien los pacientes con DBP tienen hospitalizaciones prolongadas con muchas
comorbilidades no reversibles, algunos bebés con DBPs aún pueden ser elegibles
para ECLS. Hay cuatro indicaciones principales para ECLS que se pueden aplicar a
bebés con DBP durante el deterioro agudo.
(1) La insuficiencia respiratoria hipoxémica con potencial de recuperación pulmonar es una indicación neonatal común para ECLS.30
(2) La hipercapnia con acidosis respiratoria grave también se puede manejar de manera efectiva con ECLS venovenoso.31
(3) La insuficiencia circulatoria refractaria al tratamiento médico máximo es otra indicación común. Esto se puede observar en un lactante con DBPs e insuficiencia ventricular derecha refractaria a la ventilación mecánica, sedación, relajación muscular, soporte cardiotrópico u óxido nítrico inhalado.32
(4) El shock séptico se ha
aceptado recientemente como una indicación para ELCS,33 y es una preocupación
particularmente importante en la población con DBPs, con el reconocimiento de
que puede desencadenar una exacerbación de DBPs , una crisis hipertensiva
pulmonar y dar lugar a un paro cardiopulmonar.
Como la lista de contraindicaciones para el ECLS se ha acortado en los últimos
años, el reconocimiento temprano del estado peri - paro y la activación oportuna
del protocolo ECLS pueden mejorar la sobrevida y los resultados. Un estudio
de 1982 a 2018 de bebés con DBPs que fueron tratados con ELCS demostró que el
diagnóstico primario más común en pacientes con DBP fue la infección
respiratoria viral, mientras que en pacientes con DBPs - HP, fue la insuficiencia
respiratoria seguida de HP secundaria.34 Las tasas de sobrevida fueron
66 % para DBP y 83 % para DBP - HP en bebés de dos meses a un año de edad. A
pesar de la morbilidad pulmonar significativa y el deterioro del desarrollo
neurológico, el ECLS puede resultar en tasas de supervivencia razonables para
los bebés que cumplen los criterios. Las decisiones con respecto al ECLS deben
considerar los objetivos de atención de la familia y la trayectoria de salud
general del bebé. Las discusiones sobre la elegibilidad del ECLS deben ocurrir
antes de un deterioro agudo como parte del cuidado continuo y
multidisciplinario para bebés con DBPs.
Cudidado Post-reanimación en lactantes con DBPs
En los pacientes
con DBPs , los objetivos de la atención posterior a la reanimación incluyen :
1) optimizar la homeostasis posterior al paro cardíaco para mejorar la supervivencia y minimizar las complicaciones,
2) volver a la situación inicial previa al paro cardíaco según la fase de cuidado del lactante y
3) reafirmar o revisar los objetivos de la atención y los planes a largo plazo.
La optimización
de la homeostasis posterior al paro cardíaco en esta población incluye el
control de la temperatura, evitar la hipotensión y evitar las anomalías en la
ventilación y la oxigenación, todas ellas asociadas con un aumento de la
mortalidad. La neuromonitorización puede estar indicada con un
electroencefalograma, en particular en los lactantes que requieren sedación
prolongada y parálisis después de un paro cardíaco. La neuroimagen posterior a
la reanimación con imágenes por resonancia magnética (IRM) puede ser beneficiosa
para evaluar el riesgo de lesión neurológica aguda, en particular en pacientes
que tuvieron una reanimación prolongada.35
La descompensación o el paro cardíaco pueden ocurrir en
cualquier fase del cuidado y el período posterior a la reanimación inmediato
generalmente requiere una escalación o intensificación del apoyo. Una vez que se ha
restablecido la estabilidad, el objetivo es devolver al lactante a la situación
inicial dentro de la fase actual de cuidado. La planificación de la atención a
largo plazo depende de si la causa de la descompensación es reversible o
tratable, el grado de progresión de la enfermedad y las secuelas neurológicas.
En el caso de los bebés con DBPs , los objetivos de la atención deben revisarse
con la familia y el equipo multidisciplinario. Se debe considerar la
participación de cuidados paliativos pediátricos si aún no se han implementado.
Conclusiones
Los bebés con DBPs suelen pasar por una hospitalización prolongada y reingresos frecuentes. Tienen un alto riesgo de deterioro agudo en los primeros dos años de vida, lo que puede resultar en mortalidad y morbilidad grave. La fisiopatología única y compleja de las vías aéreas , los pulmones y el sistema cardiovascular de las exacerbaciones y el paro cardíaco por DBP requiere un enfoque multidisciplinario, personalizado y basado en la fisiología, guiado por la fase de cuidado de cada bebé, los fenotipos de DBP y los desencadenantes (gatillantes) del deterioro. Dada la complejidad de la reanimación en esta población, las estrategias preventivas y la planificación del cuidado con herramientas como los planes de atención individualizados pueden ser útiles.
Tabla 1.- Fenotipos de Displasia broncopulmonar severa y Consideraciones para manejo en deterioro agudo.
|
Fenotipo |
Descripción |
Consideraciones para manejo en deterioro agudo |
||
|
Vía aérea/ Ventilación |
Circulación |
Medicamentos /Otros |
||
|
Alveolar (Parénquima pulmonar) |
Fisiopatología: es consecuencia de la alteración del crecimiento distal del pulmón, alteración de la alveolarización y disminución de la superficie para el intercambio de gases. Manifestaciones clínicas: aumento del trabajo respiratorio, necesidad de oxígeno suplementario y/o soporte de presión positiva. Una radiografía de tórax puede mostrar una disminución del volumen pulmonar o hiperinsuflación con heterogeneidad. Factores desencadenantes clave del deterioro: enfermedad pulmonar parenquimatosa aguda |
Utilice volúmenes corrientes más altos, Ti más prolongados y frecuencias más lentas para mejorar el reclutamiento pulmonar y la aireación de pulmones heterogéneos. |
Esté atento a la hiperinflación que afecta el retorno venoso y el gasto cardíaco. |
Sedación para reducir la asincronía del ventilador. Desobstrucción de las vías respiratorias en caso de obstrucción aguda o exceso de secreciones (infección). |
|
Enfermedad de las vías aéreas grandes |
Fisiopatología: alteración de arquitectura pulmonar puede causar distintos grados de traqueobroncomalacia. Los lactantes también pueden presentar lesiones adquiridas de las vías respiratorias (p. ej., estenosis subglótica). Manifestaciones clínicas: Requerimiento elevado de presión positiva al final de espiración (PEEP), a menudo desproporcionado con respecto al requerimiento de oxígeno. Radiografía de tórax puede revelar hiperinsuflación y atrapamiento de aire. Los lactantes pueden ser traqueotomía dependiente. Factores desencadenantes clave del deterioro: Obstrucción de las vías aéreas. |
Solucionar emergencias de traqueotomía (obstrucción, desplazamiento, desprendimiento). Utilizar una PEEP más alta para mantener la permeabilidad de vías aéreas y evitar atrapamiento aéreo. |
|
Sedación y relajación muscular para reducir colapso de vía aérea. |
|
Vía aérea pequeña (obstructiva) |
Fisiopatología: La alteración de la arquitectura pulmonar y la musculatura anormal de vías aéreas pequeñas causan obstrucción fija y/o reactiva con aumento de inflamación. Manifestaciones clínicas: lactantes pueden responder a broncodilatadores, regímenes de depuración de vías aéreas, corticosteroides inhalados o sistémicos. Principales factores desencadenantes del deterioro: obstrucción de las vías respiratorias, enfermedad pulmonar parenquimatosa |
Asegúrese de que la presión positiva al final de la espiración (PEEP) sea adecuada para mantener la permeabilidad de las vías aéreas pequeñas y el tiempo espiratorio adecuado para evitar el atrapamiento aéreo. Evalúe con Rx tírax para asegurarse de que no haya neumotórax si el atrapamiento aéreo ha empeorado de forma aguda. |
|
Broncodilatador y esteroides sistémicos. Limpieza de vías respiratorias en caso de obstrucción aguda. |
|
Hipertensión pulmonar crónica / Enfermedad vascular pulmonar (EVP) |
Fisiopatología: es el resultado de una disminución de la dotación vascular pulmonar, detención del crecimiento vascular, pérdida de vasos precapilares y remodelación vascular obliterante. La hipertensión pulmonar (HP) asociada con DBP (DBP-HP) es distinta de otras formas de HP crónica infantil, tal como las asociadas con cortocircuitos intra o extracardiacos de izquierda a derecha. Los lactantes con DBP también pueden verse afectados por estenosis de vena pulmonar, lo que contribuye aún más al desarrollo de HP. Manifestaciones clínicas: Los lactantes con DBP y HPc pueden ser propensos a requerimientos lábiles de oxígeno y deterioro rápido como resultado de crisis hipertensivas pulmonares. Precipitantes clave del deterioro: crisis hipertensiva pulmonar aguda |
Evite la hipoxemia con el uso liberal de oxígeno. Ventilación adecuada y depuración de CO2 para reducir la acidosis. |
Asegurar precarga adecuada. Soportes vasoactivos destinados a apoyar el ventrículo derecho, reducir la hipotensión sistémica y mejorar la perfusión coronaria |
Manejo de crisis hipertensivas pulmonares que incluyen: sedación y relajación muscular - vasodilatadores pulmonares (óxido nítrico inhalado, análogos de prostaciclina intravenosos e inhalados, inhibidores de la fosfodiesterasa tipo V intravenosos y orales, p. ej. sildenafil) |
|
Infecciosa |
Fisiopatología: Alteración de la función inmunitaria, alteración de la flora normal de vías aéreas, colonización por bacterias patógenas debido a ventilación invasiva prolongada, aspiración. Manifestaciones clínicas: Episodios recurrentes de traqueítis y/o neumonía que pueden contribuir a las exacerbaciones agudas. Precipitantes del deterioro: Infección |
Puede ser necesario considerar métodos de eliminación de secreciones y estrategias de reclutamiento para volver a airear las áreas pulmonares. |
|
Antimicrobianos específicos, teniendo en cuenta la resistencia a los antibióticos en función de infecciones/cultivos anteriores |
|
Anasarca |
Fisiopatología: Este fenotipo es poco frecuente y puede estar relacionado con una alteración de la función inmunitaria o de los vasos linfáticos. Manifestaciones clínicas: Dificultad para mantener la euvolemia, con edema tisular que no concuerda con el edema leve observado en otros bebés prematuros. |
El edema de la pared torácica puede causar una fisiopatología restrictiva que responde a las presiones medias de vías aéreas. |
Asegúrese de un estado intravascular adecuado, infundiendo preferentemente coloides en lugar de cristaloides. |
Diuresis cuidadosa dependiendo del estado del volumen intravascular. |
|
Enfermedad pulmonar intersticial |
Fisiopatología: Varía según las causas subyacentes, tal como surfactopatías congénitas. Manifestaciones clínicas: Puede presentarse en período neonatal, infancia o niñez y manifestarse con enfermedad pulmonar crónica desproporcionada con respecto a la historia neonatal y/o edad gestacional. |
Las estrategias de ventilación dependen de la patología pulmonar subyacente. A diferencia de otros fenotipos más comunes (p. ej., alveolar, de vías aéreas grandes y de vías aéreas pequeñas), los pulmones pueden ser restrictivos, homogéneos, poca compliance y pueden responder a niveles más bajos de Ti y TV y a frecuencias de ventilación más rápidas.Es posible que aún se requieran presiones de ventilación altas. Evalúe la radiografía para asegurarse de que no haya neumotórax en el contexto de una descompensación aguda. |
Dependerá de otras presentaciones fenotípicas (p. ej., enfermedad vascular pulmonar concomitante). |
Dependerá de otras presentaciones fenotípicas (por ejemplo, enfermedad vascular pulmonar concomitante). |
Referencias
Ali N, et al. Cardiopulmonary resuscitation in quaternary neonatal intensive care units: a multicenter study. Resuscitation. 2021;159:77–84.
Stickney CA, et al. Beyond the NICU: comprehensive management of infants with bronchopulmonary dysplasia in the PICU. Pediatr Pulmonol. 2023;58(5):1602–1606.
Collaco JM, McGrath-Morrow SA. Respiratory phenotypes for preterm infants, children, and adults: bronchopulmonary dysplasia and more. Ann Am Thorac Soc. 2018;15(5):530–538.
Logan JW, et al. Clinical phenotypes and management concepts for severe, established bronchopulmonary dysplasia. Paediatr Respir Rev. 2019;31:58–63.
Yallapragada S, et al. Qualitative indications for tracheostomy and chronic mechanical ventilation in patients with severe bronchopulmonary dysplasia. J Perinatol. 2021;41(11):2651–2657.
Wallis C, et al. ERS statement on tracheomalacia and bronchomalacia in children. Eur Respir J. 2019;54(3).
Doherty C, et al. Multidisciplinary guidelines for the management of paediatric tracheostomy emergencies. Anaesthesia. 2018;73(11):1400–1417.
Sahni M, Bhandari V. Bronchopulmonary dysplasia-associated pulmonary hypertension. Pediatric Med. 2019;(2).
Swier NL, et al. Pulmonary vein stenosis in neonates with severe bronchopulmonary dysplasia. Am J Perinatol. 2016;33(7):671–677.
Wang LJ, et al. Gastroesophageal reflux poses a potential risk for late complications of bronchopulmonary dysplasia: a prospective cohort study. Chest. 2020;158(4): 1596–1605.
Gien J, et al. Retrospective analysis of an interdisciplinary ventilator care program intervention on survival of infants with ventilator-dependent bronchopulmonary dysplasia. Am J Perinatol. 2017;34(2):155–163.
Midulla F, et al. Microaspiration in infants with laryngomalacia. Laryngoscope. 2004; 114(9):1592–1596.
Pullens B, Streppel M. Swallowing problems in children with a tracheostomy. Semin Pediatr Surg. 2021;30(3), 151053.
Niccum M, et al. Aspiration is associated with poor treatment response in pediatric pulmonary vein stenosis. Children. 2021;8(9).
Spaulding AB, et al. Epidemiology of Bloodstream Infections in Hospitalized Children in the United States, 2009-2016. Clin Infect Dis. 2019;69(6):995–1002.
Pediatric Acute Lung Injury Consensus Conference, G.. Pediatric acute respiratory distress syndrome: consensus recommendations from the Pediatric Acute Lung Injury Consensus Conference. Pediatr Crit Care Med,. 2015;16(5):428–439.
Hansen TP, et al. A multidisciplinary chronic lung disease team in a neonatal intensive care unit is associated with increased survival to discharge of infants with tracheostomy. J Perinatol. 2021;41(8):1963–1971.
McKinney RL, et al. Ventilatory strategies in infants with established severe bronchopulmonary dysplasia: a multicenter point prevalence study. J Pediatr. 2022; 242:248–252e1.
Niles DE, et al. A pragmatic checklist to identify pediatric ICU patients at risk for cardiac arrest or code bell activation. Resuscitation. 2016;99:33–37.
Bae G, et al. Mortality after cardiac arrest in children less than 2 years: relevant factors. Pediatr Res. 2024;95(1):200–204.
Federman M, et al. Survival with favorable neurologic outcome and quality of cardiopulmonary resuscitation following in-hospital cardiac arrest in children with cardiac disease compared with noncardiac disease. Pediatr Crit Care Med. 2024;25 (1):4–14.
Endotracheal intubation, in Textbook of Neonatal Resuscitation, G.M. Weiner and J. Zaichkin, Editors., American Academy of Pediatrics. p. 0.
Sawyer T, Yamada N, Umoren R. The difficult neonatal airway. Semin Fetal Neonatal Med. 2023;28(5), 101484.
Positive-Pressure ventilation, in Textbook of Neonatal Resuscitation, G.M. Weiner and J. Zaichkin, Editors., American Academy of Pediatrics.
Thebaud B, et al. Bronchopulmonary dysplasia. Nat Rev Dis Primers. 2019;5(1):78.
Miller AN, et al. Optimizing ventilator support in severe bronchopulmonary dysplasia in the absence of conclusive evidence. Front Pediatr. 2022;10, 1022743.
Topjian AA, et al. Part 4: pediatric basic and advanced life support: 2020 American Heart Association Guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2020;142(16_suppl_2):S469–S523.
Sawyer T, et al. Considerations on the use of neonatal and pediatric resuscitation guidelines for hospitalized neonates and infants: on behalf of the American Heart Association Emergency Cardiovascular Care Committee and the American Academy of Pediatrics. Pediatrics. 2024;153(1).
Oschman A, Rao K. Challenges in management of refractory pain and sedation in infants. Front Pharmacol. 2023;14, 1259064.
Ruttenstock E, et al. Best oxygenation index on day 1: a reliable marker for outcome and survival in infants with congenital diaphragmatic hernia. Eur J Pediatr Surg. 2015;25(1):3–8.
Conrad SA, et al. Total extracorporeal arteriovenous carbon dioxide removal in acute respiratory failure: a phase I clinical study. Intensive Care Med. 2001;27(8): 1340–1351.
Aharon AS, et al. Extracorporeal membrane oxygenation in children after repair of congenital cardiac lesions. Ann Thorac Surg. 2001;72(6):2095–2101. discussion 2101-2.
Davis AL, et al. American College of Critical Care medicine clinical practice parameters for hemodynamic support of pediatric and neonatal septic shock. Crit Care Med. 2017;45(6):1061–1093.
Pena Hernandez A, et al. Extracorporeal life support in pediatric patients with bronchopulmonary dysplasia and associated pulmonary hypertension. ASAIO J. 2020;66(9):1063–1067.
Topjian AA, et al. Pediatric post-cardiac arrest care: a scientific statement from the American Heart Association. Circulation. 2019;140(6):e194–e233.