SDR en Neonato a término
Octubre 2017
Neonato a término con distrés respiratorio
Vikramaditya Dumpa cols Division of Neonatology, Winthrop University Hospital, Mineola, NY
Department of Pediatric Radiology, and Division of Neonatology, Department of Pediatrics, Women and Children’s Hospital of Buffalo, Buffalo, NY
Neoreviews Octubre 2017
Presentación
R. Nacida, sexo femenino , nacida a las 39 semanas de una primigrávida de 21 años con antecedentes prenatales sin complicaciones y buen cuidado prenatal. Scores Apgar 6, 7 y 8 a 1, 5 y 10 minutos, respectivamente. Examen físico revela un RNT 3.3 kg AEG con quejido, taquipnea y retracción intercostal. Murmullo vesicular disminuído a derecha del tórax. Se escucha un soplo sistólico grado 2/6 en borde esternal izquierdo con ruidos cardíacos normales y buenos pulsos periféricos. El resto del examen físico en límites normales a excepción de una pequeña mancha en pabellón auricular en lado derecho.
La recién nacida requiere ventilación a presión positiva inicialmente en sala de partos y luego se coloca en CPAP con FiO2 30 %.
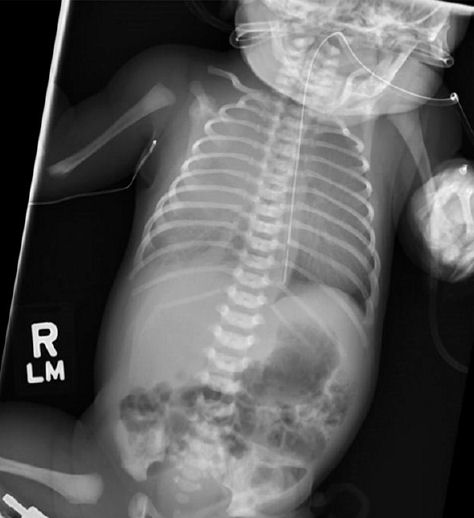
La radiografía de tórax muestra una opacificación casi completa del tórax derecho con efecto de masa y marcas pulmonares normales a izquierda (Figura 1).

Figura 1. Anteroposterior view radiograph of chest and abdomen at birth showing near-complete opacification of the right thorax.
Debido al empeoramiento del distrés
respirattorio se intuba y se traslada al centro perinatal regional para
diagnóstico y tratamiento.
Los diagnósticos diferenciales considerados en este momento para opacidad unilateral del campo pulmonar con efecto de masa incluyen : hernia diafragmática del lado derecho, malformación pulmonar congénita de vías respiratorias, secuestro pulmonar o lesión ocupante de espacio como un tumor.
Ecografía del tórax muestra una gran masa sólida en el tórax derecho con diafragma intacto, anomalía consistente con un pulmón consolidado o tumor (Figura 2).
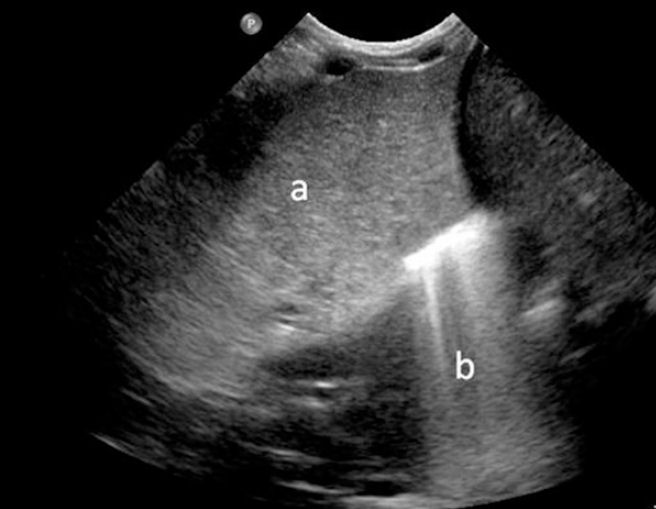
Figura 2.- Ultrasound scan of the chest, right thorax with A) a large mass on the right, consistent with a consolidated lung with an intact diaphragm, and B) liver.
Diagnóstico
La tomografía computarizada (TC) del tórax revela el diagnóstico (figuras 3 y 4). Se observa una arteria pulmonar izquierda (LPA) aberrante que surge de la arteria pulmonar derecha compatible con un cabestrillo de arteria pulmonar izquierda . Se observa un bronquio principal derecho gravemente estenótico en su origen y un posible bronquio del lóbulo superior derecho atrésico.
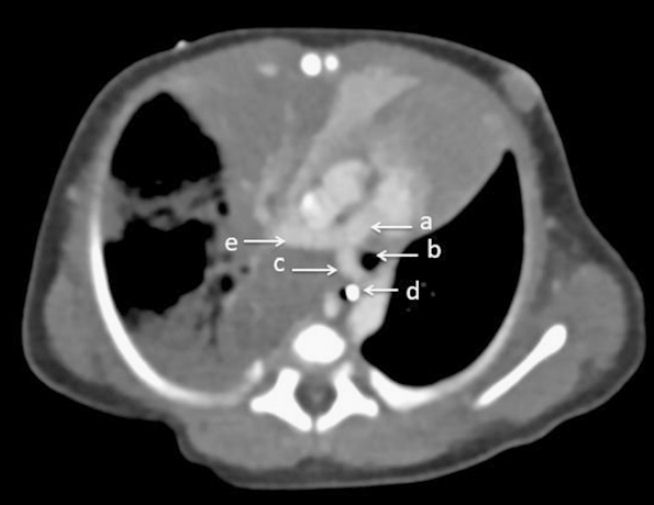
Figura 3.- Vista axial de la tomografía computarizada de tórax que muestra A) arteria pulmonar principal, B) tráquea, C) arteria pulmonar izquierda con un origen anormal desde la rama derecha en lugar de desde la arteria pulmonar principal que hace un loop (gira) alrededor de la tráquea formando una "honda o cabestrillo" D) esófago con tubo entérico y E) arteria pulmonar derecha.
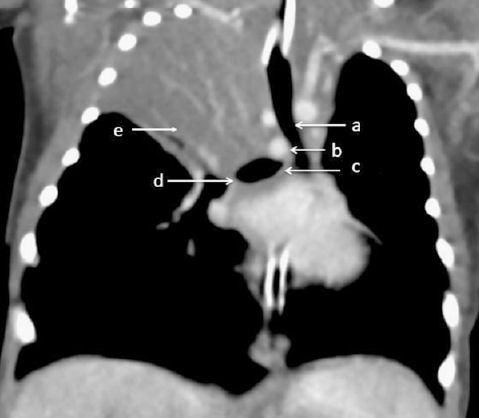
Figura 4.- Vista coronal de la tomografía computarizada de tórax que muestra A) tráquea, B) arteria pulmonar izquierda con un curso anormal alrededor de la tráquea en su bifurcación, causando estenosis del bronquio derecho, C, D) áreas de estenosis del bronquio principal derecho y E ) Lóbulo superior ateléctasico del pulmón derecho.
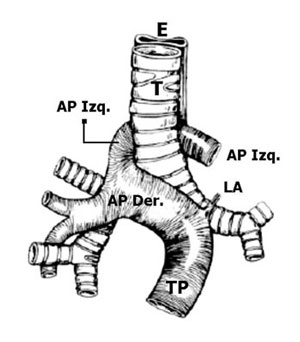
Progresión del caso
Dadas estas anomalías de las vías respiratorias y vasculares, el neonato es transferido a un centro terciario con experiencia en cirugía cardiotorácica. La reparación de la anomalía incluyó reimplantación de la LPA a la arteria pulmonar principal y ligadura del ductus arterioso. No se observó atresia del bronquio intraoperatoriamente dado que el pulmón derecho se infló bien una vez que se reparó el cabestrillo. El recién nacido se extubó al día 3 postoperatorio y se trasladó de nuevo al centro de referencia en CPAP. Posteriormente, es destetada a aire ambiental a las 4 semanas después del nacimiento. La evaluación genética no revela otras anomalías. Microarray es ofrecido y recomendado pero diferido por la familia.
La condición
El sling de arteria pulmonar izquierda es una anomalía vascular congénita rara en la cual la LPA se origina de la cara posterior de la arteria pulmonar derecha cursando sobre el bronquio principal derecho y luego posteriormente entre la tráquea y el esófago para alcanzar el pulmón izquierdo, formando un cabestrillo alrededor de la tráquea.
El sling de LPA a menudo se
asocia con estenosis traqueal congénita. Primero reportado en 1897 por Glaevecke
y Doehle, el término sling vascular fue utilizado por Contro et al en 1958 para
distinguirlo del anillo vascular. (1) (2) Más tarde, Berdon et al introdujeron
el término "complejo anillo - sling " con la descripción de las anomalías
asociadas de la vía aérea. (3) La primera corrección quirúrgica fue realizada
por Potts en 1958. (2)
La incidencia exacta no se informa debido
a la rareza de la condición. Los neonatos pueden presentar diversos grados de
distrés respiratorio en las primeras semanas o meses después del nacimiento.
Aunque los síntomas se notan precozmente generalmente se atribuyen a otras causas.
En el caso actual, la opacificación casi completa y el efecto de masa del pulmón
derecho causaron imágenes apropiadas, lo que condujo a un diagnóstico precoz. También se puede detectar un
sling LPA que se presenta como anomalía
pulmonar unilateral durante la ecografía prenatal. (4) En nuestro paciente, la
ecografía prenatal no reveló ninguna anomalía.
Los signos y síntomas dependen del grado de afectación de la vía aérea. La compresión del bronquio causa atelectasia o hiperinflación (mecanismo de válvula). La compresión traqueal puede provocar sibilancias, estridor o compromiso respiratorio grave. Ocasionalmente, se puede ver disfagia y falta de crecimiento. Los pacientes pueden ser asintomáticos inicialmente y presentar síntomas en la infancia más tardía o cuando adultos.
El sling LPA está asociado con diversas anormalidades cardiacas y no cardiacas. Las asociaciones cardiovasculares comunes incluyen comunicación interauricular, comunicación interventricular, tetralogía de Fallot, coartación de la aorta y ductus arterioso permeable. Las anomalías extracardíacas incluyen defectos vertebrales, atresia anal, fístula traqueoesofágica, anomalías renales y anomalías de las extremidades (VATERL), atresia biliar, vesícula biliar ausente, enfermedad de Hirschsprung y ano imperforado. (5) El diagnóstico del sling LPA es principalmente radiológico.
Una radiografía de tórax puede revelar hiperinflación del lado derecho o atelectasia, indentación de la tráquea, estrechamiento traqueal y bronquio traqueal del lado derecho. Un esofagrama tiene un valor limitado pero puede mostrar una hendidura anterior al esófago. La ecocardiografía puede establecer el diagnóstico de sling pulmonar y delinear otras anomalías cardíacas asociadas. La TC y la resonancia magnética (RM) son las modalidades de imagen de elección y son útiles para planificar el tratamiento quirúrgico.
La TC tiene una ventaja sobre la MRI debido a una mejor
visualización del parénquima pulmonar, un tiempo de exploración más rápido y
menor requerimiento de sedación, pero tiene la desventaja de la exposición a la
radiación ionizante. La angiografía por tomografía computarizada brinda la mayor
cantidad de información. (6) El grado de estenosis traqueal se evalúa mejor con broncoscopia.
Manejo
El manejo se basa en los síntomas clínicos y la anatomía. Los pacientes asintomáticos son seguidos clínicamente. Los pacientes sintomáticos se someten a una reparación electiva o emergente dependiendo de la estabilidad clínica. El enfoque preferido para la reparación quirúrgica es la esternotomía media con derivación (bypass) cardiopulmonar, lo que permite la reparación simultánea de otras anomalías intratorácicas, si están presentes. (7)
La reparación del sling LPA implica la reimplantacion de la LPA en la arteria pulmonar principal. Otro enfoque alternativo implica la translocación de LPA no dividida anterior a la tráquea al momento de la resección traqueal por estenosis traqueal congénita. (8)
La estenosis traqueal es la principal afección comórbida que dicta el pronóstico a largo plazo en pacientes con sling LPA. La reparación quirúrgica para la estenosis de moderada a grave puede incluir resección traqueal con anastomosis término terminal, traqueoplastia deslizante o traqueoplastia con parche. La resección traqueal con anastomosis término terminal es preferible si la estenosis involucra un segmento corto de la tráquea (25 - 40%). (9) Las complicaciones son menores y los resultados son mejores en los pacientes tratados con traqueoplastia deslizante. (10)
Lecciones para el clínico
Un sling de arteria pulmonar izquierda (LPA, por sus siglas en inglés) es una anomalía vascular congénita rara que se debe sospechar en un neonato con opacificación unilateral del campo pulmonar.
La corrección quirúrgica es el tratamiento cuando está indicado.
El resultado y el pronóstico suelen ser favorables y dependen de anomalías traqueobronquiales, cardíacas y extracardíacas asociadas.
Referencias
http://www.analesdepediatria.org/es/pdf/S1695403309006845/S300/
Glaevecke H, Doehle H. Uber cine seltene angeborene Anomalie der Pulmonalarterie. Munch Med Wochenschr. 1897;44:950–951
Contro S, Miller RA, White H, Potts WJ. Bronchial obstruction due to pulmonary artery anomalies. II. Pulmonary artery aneurysm. Circulation. 1958;17(3):424–427
Berdon WE, Baker DH, Wung JT, et al. Complete cartilage-ring tracheal stenosis associated with anomalous left pulmonary artery: the ring-sling complex. Radiology. 1984;152(1):57–64
Semple MG, Bricker L, Shaw BN, Pilling DW. Left pulmonary artery sling presenting as unilateral echogenic lung on 20-week detailed antenatal ultrasound examination. Pediatr Radiol. 2003;33 (8):567–569
Rosenbaum DG, Kasdorf E, Renjen P, Brill P, Kovanlikaya A. Sling left pulmonary artery with patent type IIA tracheobronchial anomaly and imperforate anus. Clin Imaging. 2014;38(5):743–746
Newman B, Cho Y. Left pulmonary artery sling: anatomy and imaging. Semin Ultrasound CT MR. 2010;31(2):158–170
Backer CL, Mavroudis C, Dunham ME, Holinger LD. Pulmonary artery sling: results with median sternotomy, cardiopulmonary bypass, and reimplantation. Ann Thoracic Surg. 1999;67 (6):1738–1745
Jonas RA, Spevak PJ, McGill T, Castaneda AR. Pulmonary artery sling: primary repair by tracheal resection in infancy. J Thorac Cardiovasc Surg. 1989;97(4):548–550
Anton-Pacheco JL, Cano I, Comas J, et al.Management of congenital tracheal stenosis in infancy. Eur J Cardiothorac Surg. 2006;29 (6):991–996
Fiore AC, Brown JW,Weber TR, TurrentineMW. Surgical treatment of pulmonary artery sling and tracheal stenosis. Ann Thorac Surg. 2005;79(1):38–46